Unterschied zwischen kombiniertem Gasrecht und idealem Gasrecht
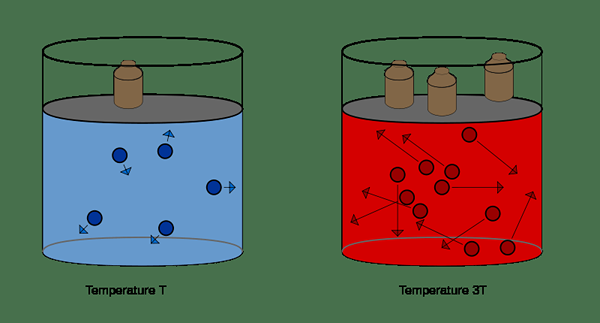
Schlüsselunterschied - kombiniertes Gasgesetz vs Ideal Gasgesetz
Wenn Sie über unterschiedliche Gase untersuchen. Diese Beziehungen werden durch das ideale Gasgesetz und das kombinierte Gasgesetz gegeben. Bei der Erläuterung dieser Gesetze wird häufig der Begriff „ideales Gas“ verwendet. Ein ideales Gas existiert in der Realität nicht, ist aber eine hypothetische Gasverbindung. Es hat keine intermolekularen Kräfte zwischen Gasmolekülen. Einige Gase können sich jedoch als ideales Gas verhalten. Die Gasgesetze werden für ideale Gase geschaffen. Bei der Verwendung dieser Gasgesetze für reale Gase werden einige Korrekturen berücksichtigt. Das kombinierte Gasgesetz ist eine Kombination aus drei Gasgesetzen; Boyles Gesetz, Charles 'Gesetz und Gay-Lussac's Law. Der Schlüsselunterschied Zwischen dem kombinierten Gasrecht und dem idealen Gasrecht ist die, die Das kombinierte Gasrecht ist eine Sammlung von drei Gasgesetzen, während ein ideales Gasrecht ein individuelles Gasgesetz ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist kombiniertes Gasrecht
3. Was ist ideales Gasgesetz
4. Beziehung zwischen kombiniertem Gasrecht und idealem Gasrecht
5. Seite an Seite Vergleich - kombiniertes Gasgesetz gegen ideales Gasrecht in tabellarischer Form
6. Zusammenfassung
Was ist kombiniertes Gasrecht?
Das kombinierte Gasrecht wird aus der Kombination von drei Gasgesetzen gebildet; Boyles Gesetz, Charles 'Gesetz und Gay-Lussac's Law. Die kombinierten Gasgesetze zeigen, dass das Verhältnis des Produkts von Druck und Volumen und die absolute Temperatur eines Gases gleich einer Konstante ist.
Pv/t = k
In welchem pus v -volumen, t Temperatur und k ist eine Konstante. Wenn das kombinierte Gasgesetz zusammen mit dem Avogadro -Gesetz verwendet wird, führt dies zu dem idealen Gasgesetz. Das kombinierte Gasgesetz hat keinen Eigentümer oder Entdecker. Die obige Beziehung kann ebenfalls wie unten angegeben werden.
P1v1/t1 = p2v2/t2
Dies ergibt die Beziehung zwischen Volumen, Temperatur und Druck eines idealen Gases in zwei Zuständen. Daher kann diese Gleichung verwendet werden, um diese Parameter in einem Anfangszustand oder endgültiger Zustand zu erklären und vorherzusagen.
Boyles Gesetz
Bei konstanter Temperatur ist das Volumen eines idealen Gases umgekehrt proportional zum Druck dieses Gases. Dies bedeutet, dass das Produkt des Anfangsdrucks (P1) und das Anfangsvolumen (V1) gleich dem Produkt des Enddrucks (P2) und des Endvolumens (V2) desselben Gass sind.
P1v1 = p2v2
Charles 'Gesetz
Bei konstantem Druck ist das Volumen eines idealen Gases direkt proportional zur Temperatur dieses Gases. Dieses Gesetz kann wie unten gegeben werden.
V1/t1 = v2/t2
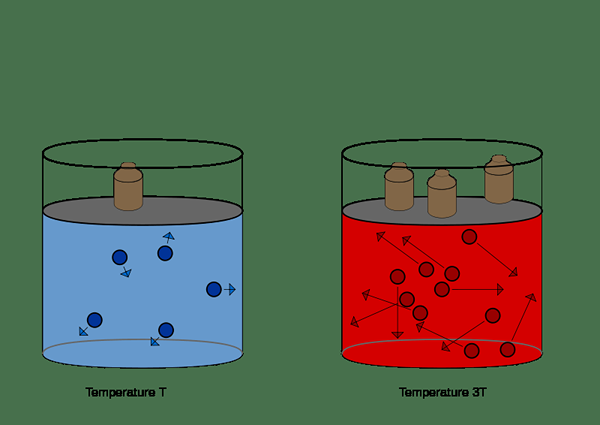
Abbildung 01: Abbildung des Druck-Volumen-Gesetzes
Gay-Lussacs Gesetz
Bei konstantem Volumen ist der Druck eines idealen Gases direkt proportional zur Temperatur des gleichen Gases. Dies kann wie unten angegeben werden,
P1/t1 = p2/t2
Was ist ideales Gasgesetz?
Das ideale Gasgesetz ist ein grundlegendes Gesetz in der Chemie und zeigt an, dass das Produkt von Druck (P) und Volumen (V) eines idealen Gases direkt proportional zum Produkt der Temperatur (T) und einer Reihe von Gaspartikeln (Gaspartikel ( N).
PV = Knt
Hier ist K eine Verhältnismäßigkeitskonstante. Es ist als Boltzmanns Konstante bekannt. Der Wert dieser Konstante ist 1.38 x 10-23 J/k. Das ideale Gas wird jedoch einfach wie folgt ausgedrückt.
Pv = nrt
Wobei n die Anzahl der vorhandenen Gasmolen ist und R die universelle Gaskonstante durch 8 gegeben ist.314 JMOL-1K-1. Diese Gleichung kann nur für ideale Gase verwendet werden. Wenn es für reale Gase verwendet werden muss, werden einige Korrekturen vorgenommen, da echte Gase viele Ausnahmen von idealen Gasen haben.
Diese neue Gleichung ist bekannt als Van der Waals Gleichung. Es ist wie unten angegeben.
(P + a n/v2) (V/n - b) = rt
In dieser Gleichung ist „A“ eine Konstante, die von der Art des Gas abhängt und B auch eine Konstante ist, die das Volumen pro Gasmole (besetzt durch die Gasmoleküle) ergibt.
Was ist die Beziehung zwischen dem kombinierten Gasrecht und dem idealen Gasrecht??
- Wenn das kombinierte Gasgesetz zusammen mit dem Avogadro -Gesetz verwendet wird, führt dies zu dem idealen Gasgesetz.
Was ist der Unterschied zwischen dem kombinierten Gasrecht und dem idealen Gasrecht?
Kombiniertes Gasrecht gegen ideales Gasrecht | |
| Das kombinierte Gasgesetz wird aus der Kombination von drei Gasgesetzen gebildet; Boyles Gesetz, Charles 'Gesetz und Gay-Lussac's Law. | Das ideale Gasgesetz ist ein grundlegendes Gesetz in der Chemie; Es zeigt an, dass das Druckprodukt (P) und das Volumen (V) eines idealen Gases direkt proportional zum Produkt der Temperatur (T) und einer Anzahl von Gaspartikeln (n) ist. |
| Formation | |
| Das kombinierte Gasgesetz wird durch die Kombination von Boyle's Law, Charles 'Gesetz und Gay-Lussac's Law gebildet. | Das ideale Gasgesetz ist ein individuelles Gesetz. |
| Gleichung | |
| Das kombinierte Gasgesetz wird durch PV/T = K gegeben | Das ideale Gasgesetz wird durch PV = NRT gegeben |
Zusammenfassung - Kombiniertes Gasgesetz vs Ideal Gasgesetz
Gasgesetze werden verwendet, um das Verhalten und die Eigenschaften eines Gases zu verstehen und vorherzusagen. Der Unterschied zwischen dem kombinierten Gasgesetz und dem idealen Gasrecht ist, dass das kombinierte Gasgesetz eine Sammlung von drei Gasgesetzen ist, während das ideale Gasrecht ein individuelles Gasgesetz ist. Das kombinierte Gasgesetz wird aus Boyle's Law, Charles 'Gesetz und Gay-Lussac's Law gebildet.
Referenz:
1.Helmenstine, Anne Marie. „Verstehen Sie das kombinierte Gasgesetz in der Chemie.”Thoughtco. Hier verfügbar
2.Helmenstine, Anne Marie. „Was ist das ideale Gasgesetz? Überprüfen Sie Ihre Chemiekonzepte.”Thoughtco. Hier verfügbar
3.„Wie unterscheidet sich das ideale Gasgesetz vom kombinierten Gasgesetz?? | sokratisch.”Org. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Temperaturdruckgesetz'by EGMASON - eigene Arbeit (CC BY -SA 3).0) über Commons Wikimedia
2.'37147128632'By Travis Wise (CC von 2.0) über Flickr


