Unterschied zwischen Koordinationszahl und Oxidationszahl
Der Schlüsselunterschied Zwischen der Koordinationszahl und der Oxidationszahl ist das Die Koordinationsnummer ist die Anzahl der Liganden, die am Metallzentrum einer Koordinationsverbindung angeschlossen sind, während die Oxidationsnummer die Ladung des zentralen Atoms ist, wenn wir alle Liganden und Elektronenpaare um ihn herum entfernen.
Wir begegnen den beiden Begriffen, Koordinationsnummer und Oxidationsnummer, im Bereich der Koordinationschemie. In der Koordinationschemie befassen wir uns mit komplexen Verbindungen, die ein Metallzentrum enthalten, das von chemischen Arten umgeben ist, die Liganden genannt werden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist die Koordinationsnummer
3. Was ist Oxidationszahl
4. Seite für Seitenvergleich - Koordinationsnummer gegen Oxidationsnummer in tabellarischer Form
5. Zusammenfassung
Was ist die Koordinationsnummer?
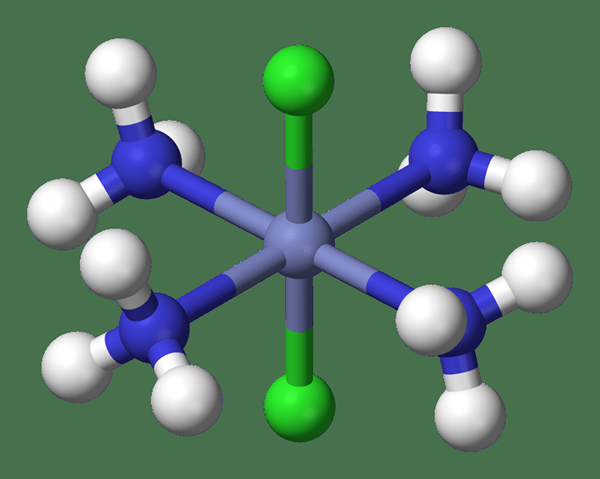
Die Koordinationsnummer ist die Anzahl der Liganden in einem Koordinierungskomplex, der am Metallzentrum befestigt ist. Deshalb nennen wir es manchmal als Ligancy. Diese Liganden können Atome, Ionen oder Moleküle sein. Normalerweise können wir die Koordinationszahlen von 2 bis 9 in Koordinationsverbindungen beobachten, aber höhere Koordinationszahlen sind sehr selten.

Abbildung 01: Eine Koordinationsverbindung mit Koordinationsnummer 6
Diese Zahl beinhaltet jedoch nicht die Anzahl der Elektronenpaare um das Metallzentrum. Zum Beispiel [MO (CN)8]4- ist ein Koordinierungskomplex mit Molybdän als Metallzentrum und die Koordinationsnummer beträgt 8, da am Metallcenter acht Liganden befestigt sind.
Was ist Oxidationszahl?
Die Oxidationszahl ist die Ladung, die das zentrale Atom haben würde, wenn alle mit dem Atom geteilten Liganden und Elektronenpaare entfernt würden. Darüber hinaus gilt diese Zahl für Übergangsmetalle, da sich die Koordinationskomplexe über Bindungsliganden mit Übergangsmetallen bilden. Übergangsmetalle sind die chemischen Elemente in Gruppe 3 bis 12 im D -Block der Periodenzüchter. Typischerweise können sie aufgrund der geringen Reaktivität von ungepaarten D -Elektronen mehrere Oxidationszustände bilden. Zum Beispiel die Oxidationszahl von Eisen (Fe) im Koordinierungskomplex [Fe (CN)6]3- ist +3. Wir können diesen Wert erhalten, indem wir alle Liganden (CN -Liganden) mit ihrer Ladung entfernen.
Gesamtgebühr beträgt -3
Entfernen Sie -1 x 6 (weil es sechs Liganden gibt und ein CN -Ligand -1 -Ladung ist)
Dann Oxidationszahl von Fe = -3 -(-6) = +3
Was ist der Unterschied zwischen der Koordinationszahl und der Oxidationszahl?
Der wichtigste Unterschied zwischen der Koordinationszahl und der Oxidationszahl besteht darin. Darüber hinaus geben wir die Koordinationsnummer für eine ganze Koordinationsverbindung an, die Oxidationszahl ist jedoch für das Metallzentrum. Zum Beispiel die Koordinationsnummer des [MO (CN)8]4- Der Komplex beträgt 8, während die Oxidationszahl von Eisen (Fe) im Koordinierungskomplex [Fe (CN)6]3- ist +3.
Die folgende Infografik fasst den Unterschied zwischen Koordinationszahl und Oxidationszahl zusammen.
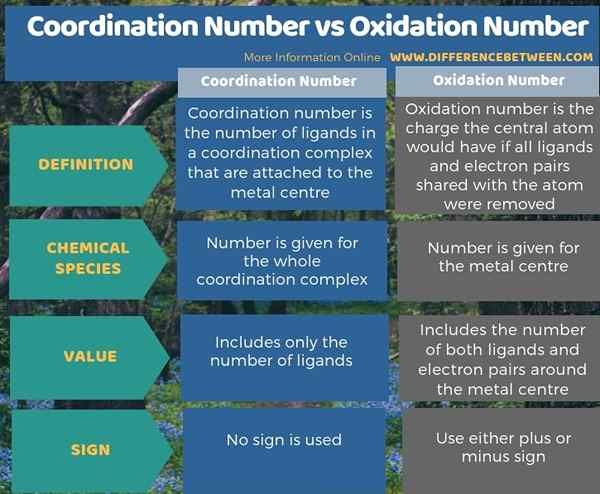
Zusammenfassung -Koordinationsnummer gegen Oxidationsnummer
Koordinationsnummer und Oxidationsnummer sind zwei verschiedene Begriffe in der Koordinationschemie. Die Koordinationsnummer ist die Anzahl der Liganden Das Metallzentrum einer Koordinierungsverbindung hält. Im Gegensatz dazu ist die Oxidationszahl die Ladung des zentralen Atoms, wenn wir alle Liganden und Elektronenpaare um ihn herum entfernen. Dies ist also der Hauptunterschied zwischen der Koordinationszahl und der Oxidationszahl.
Referenz:
1. Helmenstine, Todd. „Der Unterschied zwischen Oxidationszustand und Oxidationszahl.”Thoughtco, Jul. 3, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Trans-Dichlorotetraamminecobalt (iii)" von Benjah-BMM27-eigene Arbeit (Public Domain) über Commons Wikimedia


