Unterschied zwischen kovalenten und nichtkovalenten Bindungen
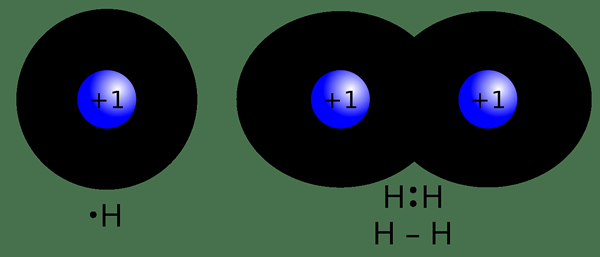
Der Schlüsselunterschied Zwischen kovalenten und nichtkovalenten Bindungen befindet sich das Kovalente Bindungen bilden sich, wenn zwei Atome ihre Elektronen miteinander teilen, während sich nichtkovalente Bindungen entweder durch vollständiges Austausch von Elektronen zwischen zwei Atomen oder ohne Elektron.
Es gibt vier Haupttypen chemischer Bindungen: kovalente Bindungen, Ionenbindungen, Wasserstoffbrückenbindungen und Van der Waals -Wechselwirkungen. Wenn wir chemische Bindungen als kovalente und nichtkovalente Bindungen, ionische, Wasserstoffbrückenbindungen und Van -der -Waals -Wechselwirkungen unter die Kategorie nichtkovalenter Bindungen kategorisieren, fallen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind kovalente Bindungen
3. Was sind nichtkovalente Bindungen?
4. Seite an Seitenvergleich - kovalent gegen nichtkovalente Bindungen in tabellarischer Form
5. Zusammenfassung
Was sind kovalente Bindungen?
Eine kovalente Bindung ist eine Art chemischer Bindung, die sich bildet, wenn zwei Atome ein Elektronenpaar zwischen sich haben. Es wird als "molekulare Bindung" benannt. Diese Bindungen bilden sich, wenn zwischen Atomen „gemeinsame Paare“ oder „Bindungspaare“ bestehen. Eine kovalente Bindung bildet sich aufgrund des stabilen Gleichgewichts der attraktiven und abstoßenden Kräfte zwischen Atomen, wenn sie Elektronen teilen. Durch das Teilen von Elektronen zwischen Atomen ermöglicht es jedem Atom, das Äquivalent einer vollen Außenhülle zu haben. Normalerweise bildet diese Art von Bindungsformen zwischen zwei nichtmetalischen Atomen mit nahezu ähnlichen Elektronegativitätswerten oder zwischen einem Elektron und einem positiv geladenen Metallion.

Es gibt zwei Haupttypen kovalenter Bindungen: polare kovalente Bindungen und nichtpolare kovalente Bindungen. Es gibt polare kovalente Bindungen zwischen zwei Atomen mit einem Unterschied zwischen ihren Elektronegativitätswerten im Bereich von 0.4 bis 1.7. Nichtpolare kovalente Bindungen bilden sich, wenn dieser Unterschied niedriger als 0 ist.4. Hier bedeutet ein hoher Unterschied zwischen den Elektronegativitätswerten, ein Atom (mit dem höheren Elektronegativitätswert) die Elektronen mehr als das andere Atom anzieht, wodurch die Bindung polar polar macht.
Nach der Anzahl der Elektronenpaare, die zwischen zwei Atomen geteilt werden Drei Elektronenpaare.
Was sind nichtkovalente Bindungen??
Nichtkovalente Bindungen sind chemische Bindungen. Es gibt drei Arten von nichtkovalenten Bindungen als ionische Bindungen, Wasserstoffbrückenbindungen und Van der Waals -Wechselwirkungen.
Ein Atom kann Elektronen gewinnen oder verlieren und negative oder positive geladene Partikel bilden, um eine stabile Elektronenkonfiguration zu erhalten. Wir nennen diese Partikel "Ionen". Sie haben elektrostatische Wechselwirkungen zwischen ihnen. Eine ionische Bindung kann als Anziehungskraft zwischen diesen entgegengesetzt geladenen Ionen beschrieben werden. Die elektrostatische Wechselwirkung zwischen Ionen wird durch die Elektronegativität der Atome in der ionischen Bindung beeinflusst. Daher ergibt die Elektronegativität die Affinität der Atome zu Elektronen. Ein Atom mit hoher Elektronegativität kann Elektronen aus einem Atom mit geringer Elektronegativität anziehen, um eine ionische Bindung zu bilden.

Wasserstoffbrückenbindungen sind eine weitere nichtkovalente Bindung. Es ist eine Art Anziehungskraft zwischen zwei Atomen von zwei verschiedenen Molekülen, was eine schwache Anziehungskraft ist. Im Vergleich zu anderen Arten von intramolekularen Kräften wie polarpolaren Wechselwirkungen sind nichtpolar-nonpolare Wechselwirkungen wie Vander Waal-Kräfte Wasserstoffbindungen stärker. Normalerweise bilden Wasserstoffbrückenbindungen zwischen polaren kovalenten Molekülen. Diese Moleküle enthalten polare kovalente Bindungen, die sich aufgrund der Differenz der Elektronegativitätswerte der Atome, die sich in der kovalenten Bindung befinden.
Van der Waals -Wechselwirkungen sind eine andere Art von nichtkovalenter Bindung. Es sind schwache Anziehungskräfte zwischen zwei Atomen in zwei unpolaren Molekülen. Eine Wechselwirkung von Van der Waals ist entweder eine induzierte Anziehung oder eine Abstoßung, die durch Korrelationen in den schwankenden Polarisationen von Partikeln in der Nähe verursacht wird.
Was ist der Unterschied zwischen kovalenten und nichtkovalenten Bindungen?
Kovalente und nichtkovalente Bindungen sind die beiden breiten Klassen chemischer Bindungen in der Chemie. Kovalente Bindungen sind in drei weiteren Untergruppen als Ionenbindungen, Wasserstoffbrückenbindungen und Van der Waals -Wechselwirkungen zu finden. Der Hauptunterschied zwischen kovalenten und nichtkovalenten Bindungen besteht darin, dass sich kovalente Bindungen bilden, wenn sich zwei Atome miteinander teilen, während sich nichtkovalente Bindungen bilden.
Nachfolgend infografik listet die Unterschiede zwischen kovalenten und nichtkovalenten Bindungen ausführlicher auf.

Zusammenfassung -kovalent gegenüber nichtkovalenten Bindungen
Kovalente und nichtkovalente Bindungen sind die beiden breiten Klassen chemischer Bindungen in der Chemie. Kovalente Bindungen sind in drei weiteren Untergruppen als Ionenbindungen, Wasserstoffbrückenbindungen und Van der Waals -Wechselwirkungen zu finden. Der Hauptunterschied zwischen kovalenten und nichtkovalenten Bindungen besteht darin, dass sich kovalente Bindungen bilden, wenn sich zwei Atome miteinander teilen, während sich nichtkovalente Bindungen bilden.
Referenz:
1. „Van der Waals Streitkräfte.”Chemistry Libretexten, Libretexte, 15. August. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Kovalente Bindung Wasserstoff" von Jacek FH - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia
2. "Ionische Bindung" von Jayron32.sprechen.Beiträge - Ich habe diese Arbeit ganz von mir selbst erstellt. (CC BY-SA 3.0) über Commons Wikimedia


