Unterschied zwischen Nernst Potential und Zeta -Potential
Der Schlüsselunterschied Zwischen dem Nernst -Potential und dem Zeta -Potenzial befindet sich das Für eine biologische Zelle oder eine elektrochemische Zelle wird das Nernst -Potential angegeben, während für eine kolloidale Dispersion Zeta -Potential angegeben wird.
Nernst -Potential und Zeta -Potenzial sind Begriffe in der physikalischen Chemie, die den Potentialdifferenz zwischen etwas beschreiben, e.G. Die Zellmembran, die elektrochemische Zelle, die Membran eines dispergierten Teilchens in einem Dispersionsmedium usw.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Nernst Potenzial?
3. Was ist Zeta -Potenzial
4. Seite für Seitenvergleich - Nernst -Potential gegen Zeta -Potential in tabellarischer Form
5. Zusammenfassung
Was ist Nernst Potenzial??
Nernst -Potential oder Umkehrpotential ist das Potenzial über eine Zellmembran, die sich der Nettodiffusion eines bestimmten Ions durch die Membran widersetzt. Daher enthält dieser Begriff Bewerbungen in der Biochemie. Wir können das Nernst -Potential durch das Verhältnis der Konzentrationen dieses spezifischen Ions (das versucht, durch die Zellmembran zu gehen) innerhalb der Zelle und außerhalb der Zelle bestimmen. Dieser Begriff wird jedoch auch in der Elektrochemie in Bezug auf elektrochemische Zellen verwendet. Die Gleichung, die zur Bestimmung des Nernst -Potentials verwendet wird, wird als Nernst -Gleichung bezeichnet.
Die Nernst -Gleichung kann als eine mathematische Expression beschrieben werden, die die Beziehung zwischen dem Reduktionspotential und dem Standardreduktionspotential einer elektrochemischen Zelle ergibt. Diese Gleichung wurde nach dem Wissenschaftler Walther Nernst benannt. Darüber hinaus wurde diese Gleichung unter Verwendung der anderen Faktoren entwickelt, die die elektrochemische Oxidations- und Reduktionsreaktionen beeinflussen, wie z.
Um die Nernst -Gleichung zu erhalten, müssen wir die Standardänderungen in der freien Energie von Gibbs berücksichtigen, die mit elektrochemischen Transformationen in der Zelle verbunden sind. Die Reduktionsreaktion einer elektrochemischen Zelle kann wie folgt angegeben werden:
Ox+ z e- ⟶ rot
In der Thermodynamik ist die tatsächliche Veränderung der freien Energie der Reaktion,
E = edie Ermäßigung - EOxidation
Wir können die freie Energie (ΔG) mit der E (Potentialdifferenz) wie folgt in Beziehung setzen:
Δg = -nfe
Wenn n die Anzahl der Elektronen ist, die beim Fortschreiten zwischen chemischen Spezies zwischen chemischen Spezies übertragen werden, ist F die Faraday -Konstante. Wenn wir die Standardbedingungen berücksichtigen, lautet die Gleichung wie folgt:
ΔG0 = -Nfe0
Wir können Gibbs freie Energie der nicht standardmäßigen Bedingungen mit der Gibbs-Energie der Standardbedingungen über die folgende Gleichung in Verbindung bringen.
ΔG = ΔG0 + Rtlnq
Anschließend können wir die obigen Gleichungen in diese Standardgleichung ersetzen, um die Nernst -Gleichung wie folgt zu erhalten:
-nfe = -nfe0 + Rtlnq
Dann lautet die Nernst -Gleichung wie folgt:
E = e0 - (RTLNQ/NF)
Was ist Zeta -Potenzial?
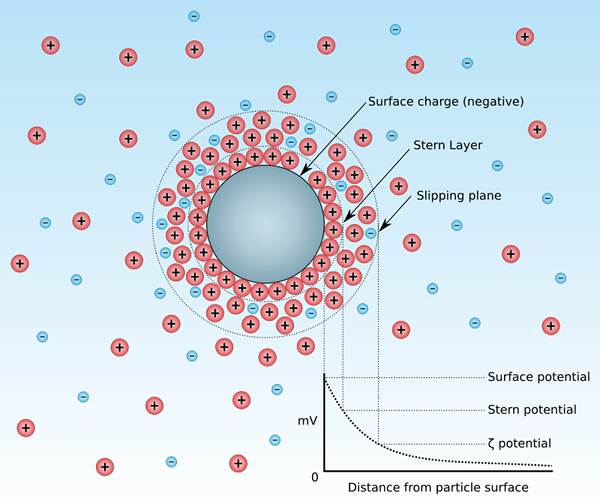
Zeta -Potential ist das elektrokinetische Potential einer kolloidalen Dispersion. Dieser Begriff stammt aus dem griechischen Buchstaben "Zeta". Im Allgemeinen nennen wir diesen elektrokinetischen Potential Zeta -Potenzial. Mit anderen Worten, Zeta -Potential ist die Potentialdifferenz zwischen dem Dispersionsmedium und der stationären Schicht der Fluid, die am dispergierten Partikel der kolloidalen Dispersion gebunden ist. Das bedeutet. Wir können zwei Arten von Zeta -Potential erkennen: positives und negatives Zeta -Potential. Darüber hinaus messen wir dieses Potenzial als die Geschwindigkeit der Partikel in einem D.C. elektrisches Feld.

Abbildung 01: Ein Teilchen in einer kolloidalen Suspension
Unter den beiden Typen zeigt das positive Zeta -Potential an, dass die dispergierten Partikel in der Suspension, in der wir das Zeta -Potential messen, eine positive Ladung haben. Wenn wir die Werte berücksichtigen, gibt es keinen signifikanten Unterschied zwischen positivem und negativem Zeta -Potential.
Andererseits zeigt das negative Zeta -Potential an, dass die dispergierten Partikel in der Aufhängung, in der wir das Zeta -Potential messen, eine negative Ladung haben. Somit ist die Ladung der dispergierten Partikel negativ.
Was ist der Unterschied zwischen dem Nernst -Potential und dem Zeta -Potenzial?
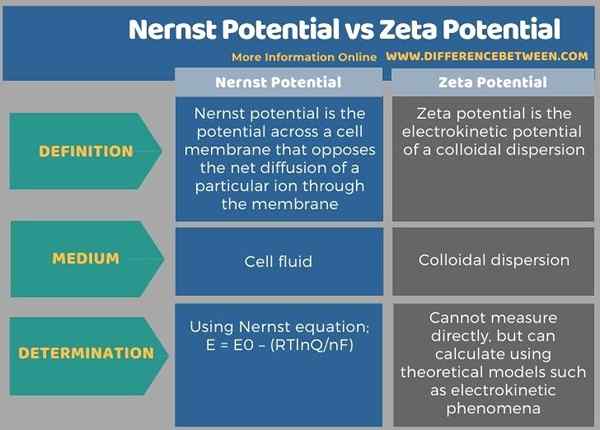
Nernst Potential und Zeta -Potential werden in der physikalischen Chemie eingesetzt. Der Hauptunterschied zwischen dem Nernst -Potential und dem Zeta -Potential besteht darin, dass das Nernst -Potential für eine biologische Zelle oder eine elektrochemische Zelle angegeben ist, während für eine kolloidale Dispersion Zeta -Potential angegeben wird.
Die folgende Infografik zeigt mehr Unterschiede zwischen dem Nernst -Potential und dem Zeta -Potential.
Zusammenfassung -Nernst -Potential gegen Zeta -Potential
Die Begriffe des Nernst -Potentials und des Zeta -Potentials werden in der physikalischen Chemie eingesetzt. Der Hauptunterschied zwischen dem Nernst -Potential und dem Zeta -Potential besteht darin, dass das Nernst -Potential für eine biologische Zelle oder eine elektrochemische Zelle angegeben ist, während für eine kolloidale Dispersion Zeta -Potential angegeben wird.
Referenz:
1. "Zetapotential.”Wikipedia. 23. Juni 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Diagramm des Zeta -Potentials und Slipping Planev2" durch modifiziert und umgewandelt in SVG von MJones1984 umgewandelt. Originalarbeit von Larryisgood. -(CC BY-SA 3.0) über Commons Wikimedia


