Differenz zwischen dπ-dπ-Bindung und Deltabindung
Der Schlüsselunterschied Zwischen Dπ-Dπ-Bindung und Delta-Bindung ist das Dπ-Dπ-Bindungsformen zwischen einem gefüllten D-Atom-Orbital und einem leeren D-Atom-Orbital, während die Delta-Bindungsformen zwischen vier Lappen eines Atomkörpers und vier Lappen eines anderen Atom-Orbitals beinhalteten.
Sowohl Dπ-Dπ-Bindung als auch Delta-Bindungsform über die Überlappung von Atomorbitalen. Die Überlappung von Orbitalen in der Bildung dπ-dπ-Bindungen erzeugt eine Koordinatenbindung, während sich die Überlappung in der Delta-Bindungsbildung eine kovalente chemische Bindung bildet.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist dπ-dπ-Bindung
3. Was ist Delta Bond
4. Seite für Seitenvergleich - Dπ -dπ -Bindung gegen Deltabindung in tabellarischer Form
5. Zusammenfassung
Was ist dπ-dπ-Bindung?
Eine Dπ-Dπ-Bindung ist eine Art kovalente chemische Bindung, bei der ein Metall durch die Überlappung ihrer D-Orbitale mit einem Liganden bindet. Mit anderen Worten, diese Art von kovalenten chemischen Bindungen bildet sich, wenn das gefüllte D -Orbital des Übergangsmetalls einige seiner Elektronen an die leeren Orbitale eines Liganden spendet. Daher werden diese chemischen Verbindungen als Koordinationskomplexe bezeichnet.
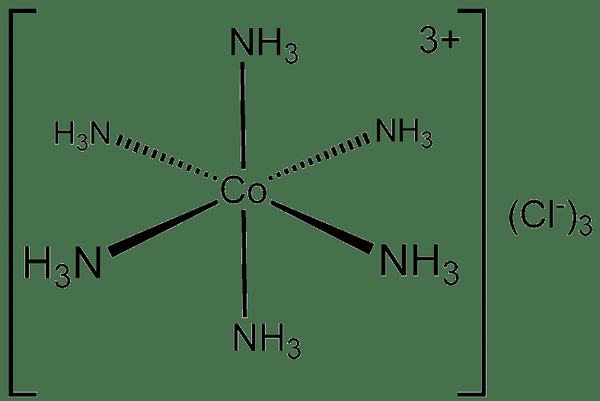
Abbildung 01: Eine kohlenvolle Kovalentverbindung
Im Gegensatz zu Delta-Bindungen, die der Struktur einer dπ-dπ-Bindung ähneln. Außerdem kann eine Delta-Bindung zwischen zwei Atomen auftreten, die Atomorbitale betreffen, während eine Dπ-Dπ-Bindung zwischen einem Übergangsmetall auftritt, der die D-Elektronenkonfiguration abgeschlossen hat, und einem Liganden mit leeren Orbitalen in D-Elektronenschale.
Was ist eine Delta -Bindung??
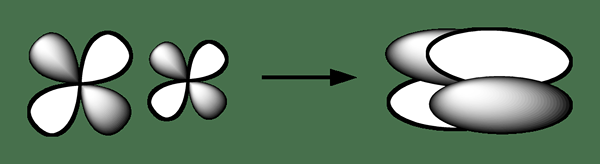
Delta -Bindung ist eine Art chemische Bindung, bei der vier Lappen eines Atomkörpers in der Regel mit vier Lappen eines anderen überlappen, um diese Bindung zu bilden. Diese Art von Orbitalüberlappung führt zur Bildung eines molekularen Orbitals (Bindung), das aus zwei Knotenebenen besteht, die die internukleäre Achse enthalten, und die beide Atome durchläuft. Der griechische Brief für Delta -Zeichen "" wird für die Notation einer Delta -Bindung verwendet.

Abbildung 02: Bildung einer chemischen Delta -Bindung
Im Allgemeinen ähnelt die Orbitalsymmetrie der Delta -Bindung der üblichen Art des D -Atom -Orbitals bei der Betrachtung der Bindungsachse. Wir können diese Art der chemischen Bindung in Atomen beobachten, die D -Atomorbitale besetzt haben, die geringe Energie enthält, um an der kovalenten chemischen Bindung teilzunehmen. Zum Beispiel zeigen Übergangsmetalle, die sich in metallischen chemischen Arten befinden, eine Delta -Bindung; Chemische Verbindungen einiger Metalle wie Rhenium, Molybdän und Chrom enthalten Vierfachbindungen. Eine Vierfachanleihe besteht aus einer Sigma -Bindung, zwei PI -Anleihen und einer Delta -Bindung.
Wenn wir die Orbitalsymmetrie einer Delta -Bindung berücksichtigen, können wir feststellen, dass sich die Symmetrie von der eines PI -Antibonditals unterscheidet. Ein PI -Antibond -Orbital enthält eine Knotenebene, die aus der internukleären Achse und einer anderen Knotenebene besteht, die senkrecht zur Achse zwischen den Atomen ist.
Der Wissenschaftler Robert Mulliken stellte 1931 die Delta -Notation vor. Er identifizierte diese Bindung zunächst unter Verwendung des chemischen Verbindungskalium -Octachlorodirhenat (III).
Was ist der Unterschied zwischen Dπ-Dπ-Bindung und Deltabindung?
Dπ-Dπ-Bindung und Deltabindung sind zwei Arten kovalenter chemischer Bindungen. Der Schlüsselunterschied zwischen dπ-dπ-Bindung und Delta-Bindung besteht darin, dass sich die Dπ-Dπ-Bindung zwischen einem gefüllten D-Atom-Orbital und einem leeren D-Atom-Orbital bildet, während die Delta-Bindungsbindung zwischen vier Lappen eines Atom-Orbitals und vier Lappen eines anderen in der Lage ist, Atom-Orbital zu beteiligen.
Bevor die Infografik die Unterschiede zwischen Dπ-Dπ-Bindung und Deltabindung in tabellarischer Form fasst.
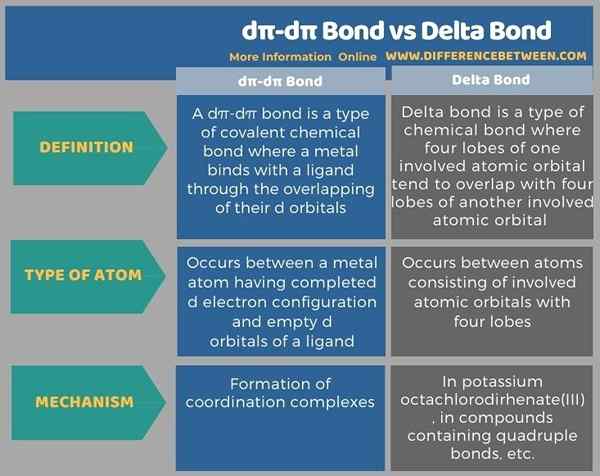
Zusammenfassung -Dπ -dπ -Bindung gegen Delta -Bindung
Dπ-Dπ-Bindung und die Delta-Bindung sind zwei Arten kovalenter chemischer Bindungen. Der Schlüsselunterschied zwischen dπ-dπ-Bindung und Delta-Bindung besteht darin, dass sich die Dπ-Dπ-Bindung zwischen einem gefüllten D-Atom-Orbital und einem leeren D-Atom-Orbital bildet, während die Delta-Bindungsbindung zwischen vier Lappen eines Atom-Orbitals und vier Lappen eines anderen in der Lage ist, Atom-Orbital zu beteiligen.
Bild mit freundlicher Genehmigung:
1. "COA6CL3" - Angenommen - keine maschinenlesbare Quelle zur Verfügung gestellt. Eigene Arbeit angenommen (basierend auf Urheberrechtsansprüchen). (Public Domain) über Commons Wikimedia
2. "Delta-Bond-Formation-2D" von Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia


