Unterschied zwischen Diamond Graphit und Fulleren

Der Schlüsselunterschied Zwischen Diamond Graphit und Fulleren ist das Diamond hat eine Diamant -Kubikkristallstruktur und Graphit hat eine hexagonale Kristallstruktur, während Fulleren als großes Sphäroidalmolekül auftritt.
Diamant, Graphit und Fulleren sind unterschiedliche Allotröme des Kohlenstoffs des chemischen Elements. Alle diese Verbindungen haben nur Kohlenstoffatome in der Zusammensetzung, aber die Anordnung der Kohlenstoffatome unterscheidet sich voneinander.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Diamant
3. Was ist Graphit
4. Was ist Fulleren
5. Nebeneinander Vergleich - Diamond vs Graphit gegen Fulleren in tabellarischer Form
6. Zusammenfassung
Was ist Diamant?
Diamond ist ein Allotrop von Kohlenstoff, das die Diamant -Kubikkristallstruktur hat. Es befindet sich im Festkörper bei Standardtemperatur und Druck. Darüber hinaus hat es die höchste Härte unter allen Materialien und die höchste thermische Leitfähigkeit. Diamanten fallen unter die Kategorie einheimischer Mineralien, und normalerweise ist seine Farbe gelb, braun oder grau bis farblos. Darüber hinaus ist die Spaltung dieses Materials in vier Richtungen perfekt, und die Fraktur ist unregelmäßig. Der Mineralstreifen eines Diamanten ist farblos. Bei der Betrachtung der optischen Eigenschaften ist Diamond isotrop ist.

Abbildung 01: Diamant
In diesem Material sind die Kohlenstoffatome SP3 hybridisiert. Jedes Atom bildet mit einem anderen Atom eine Tetraedrische. Die tetraedrischen Strukturen sind starr und die Bindungen zwischen Atomen sehr stark. Darüber hinaus hat Diamond die größte Anzahl von Atomen in einem Materialsvolumen ein.
Was ist Graphit?
Graphit ist ein Allotrop von Kohlenstoff mit der hexagonalen Kristallstruktur. Die Verbindung tritt natürlich als Graphiterze auf; So können wir dieses Material durch den Bergbau erhalten. Es ist das stabilste Allotrop von Kohlenstoff bei Standardtemperatur und Druck. Darüber hinaus kann Graphit unter sehr hohen Temperatur- und Druckbedingungen in Diamant umwandeln. Es hat eine hohe elektrische Leitfähigkeit.

Abbildung 02: Graphit
Graphit fällt auch unter die Kategorie der nativen Mineralien. Die Farbe kann von Eisenschwarz bis Stahlgrau variieren. Darüber hinaus ist die Spaltung dieses Materials basal und die Fraktur ist schuppig. Die Härte ist sehr niedrig und hat einen metallischen, erdigen Glanz. Der Mineralstreifen von Graphit ist schwarz. Bei der Betrachtung der optischen Eigenschaften ist der Graphit uniaxial.
Was ist Fulleren?
Fulleren ist ein Allotrop von Kohlenstoff, das eine große kugelförmige Struktur aufweist. Die Kohlenstoffatome in diesem Allotrop verbinden sich über einzelne und doppelte Bindungen miteinander. Darüber hinaus ist die kugelförmige Struktur ein geschlossenes oder teilweise geschlossenes Netz mit verschmolzenen Ringen mit 5 bis 7 Kohlenstoffatomen. Sie sind sp2 Hybridisierte Atome. Die Struktur hat jedoch einen Winkelstamm zwischen Atomen.
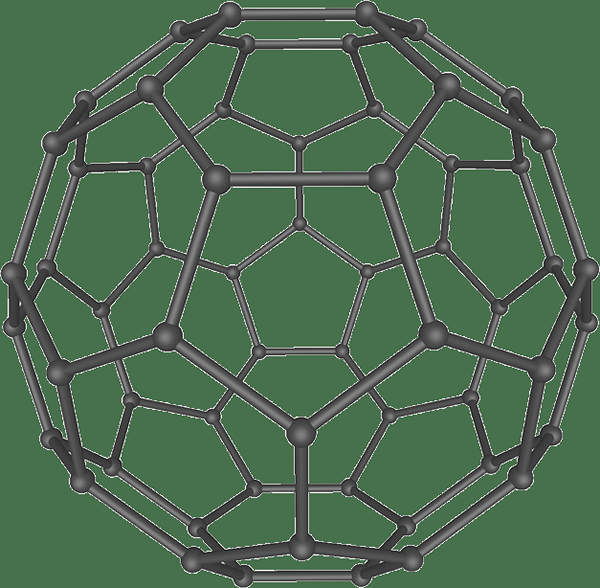
Abbildung 03: Struktur der Fulleren -Kugel
Darüber hinaus sind Fullerenes in organischen Lösungsmitteln wie Toluol, Chlorobenzol usw. löslich. Im Allgemeinen ist dieses Material ein elektrischer Isolator.
Was ist der Unterschied zwischen Diamond Graphit und Fulleren?
Diamant, Graphit und Fulleren sind Kohlenstoffallotrope. Der wichtigste Unterschied zwischen Diamond Graphit und Fulleren besteht darin, dass Diamond eine Diamant -Kubikkristallstruktur hat und Graphit eine hexagonale Kristallstruktur aufweist, während Fulleren als großes sphäroidales Molekül auftritt. Darüber hinaus ist Diamond das härteste natürlich vorkommende Material auf der Erde, aber Graphit und Fulleren haben eine vergleichsweise geringe Härte.
Darüber hinaus besteht ein weiterer Unterschied zwischen Diamond Graphit und Fulleren darin, dass die Kohlenstoffatome eines Diamanten SP sind3 hybridisiert, aber in Graphit und Fulleren sind sie SP2 hybridisiert. Wenn Sie die Geometrie um ein Kohlenstoffatom im Diamanten berücksichtigen, ist es tetraedrisch und in Graphit ist es ein trigonaler Planar, während es in Fulleren kugelförmig ist.

Zusammenfassung -Diamond vs Graphit gegen Fullerene
Diamant, Graphit und Fulleren sind Kohlenstoffallotrope. Zusammenfassend lässt sich sagen.
Referenz:
1. "Graphit.”Geologie, hier erhältlich.
2. "Diamant.”Wikipedia, Wikimedia Foundation, 13. Juli 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Vickers Anvil Diamonds" von R. Tanaka -(CC von 3.0) über Commons Wikimedia
2. "Graphit-233436" von Rob Lavinsky, Irocks.com - (cc by -sa 3.0) über Commons Wikimedia
3. "C60A" - Der ursprüngliche Uploader war Mstroeck bei englischer Wikipedia.Spätere Versionen wurden von Bryn C bei en hochgeladen.Wikipedia. - Übertragen von en.Wikipedia nach Commons (CC BY-SA 3.0) über Commons Wikimedia


