Unterschied zwischen elektrochemischer Zelle und galvanischer Zelle
Der Schlüsselunterschied zwischen elektrochemischer Zelle und galvanischer Zelle ist das Die meisten elektrochemischen Zellen neigen dazu, elektrische Energie in chemische Energie umzuwandeln, während galvanische Zellen dazu neigen, chemische Energie in elektrische Energie umzuwandeln.
Oxidations- und Reduktionsreaktionen spielen eine wichtige Rolle in der Elektrochemie. Bei einer Oxidationsreduktionsreaktion werden Elektronen von einem Reaktanten auf einen anderen übertragen. Die Substanz, die Elektronen akzeptiert, ist das Reduktionsmittel, während die Substanz, die das Elektron verschenkt. Das Reduktionsmittel ist dafür verantwortlich, den anderen Reaktanten während der Oxidation selbst zu reduzieren. Für das Oxidationsmittel ist dies umgekehrt. Diese Reaktionen treten in zwei Halbreaktionen auf, um getrennte Oxidationen und Reduktionen zu zeigen. Somit zeigt es die Anzahl der Elektronen, die sich ein- oder ausziehen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist eine elektrochemische Zelle
3. Was ist eine galvanische Zelle
4. Seite an Seite Vergleich - Elektrochemische Zelle gegen galvanische Zelle in tabellarischer Form
5. Zusammenfassung
Was ist eine elektrochemische Zelle?
Eine elektrochemische Zelle ist eine Kombination eines reduzierenden und oxidierenden Mittel, das physisch voneinander getrennt ist. Normalerweise machen wir diese Trennung durch eine Salzbrücke. Obwohl sie physisch getrennt sind, stehen beide Halbzellen in chemischem Kontakt miteinander. Elektrolytische und galvanische Zellen sind zwei Arten von elektrochemischen Zellen.
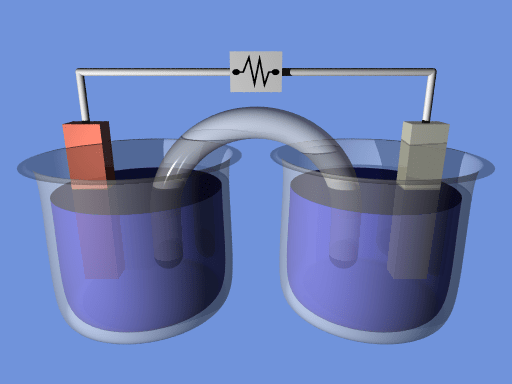
Oxidationsreduktionsreaktionen finden sowohl in elektrolytischen als auch in galvanischen Zellen statt. Daher gibt es in einer elektrochemischen Zelle zwei Elektroden als Anode und eine Kathode. Beide Elektroden verbinden sich extern mit einem hochbeständigen Voltmeter; Daher wird der Strom zwischen den Elektroden nicht übertragen. Daher trägt dieser Voltmeter dazu bei, eine bestimmte Spannung zwischen den Elektroden aufrechtzuerhalten, in denen Oxidationsreaktionen stattfinden.

Abbildung 01: Elektrochemische Zelle
Die Oxidationsreaktion findet auf der Anode statt, während die Reduktionsreaktion auf der Kathode stattfindet. Wir müssen sie in separate Elektrolytlösungen eintauchen. Normalerweise sind diese Lösungen ionische Lösungen im Zusammenhang mit der Art der Elektrode. Zum Beispiel tauchen wir Kupferelektroden in eine Kupfersulfatlösung und Silberelektroden in eine Silberchloridlösung ein. Diese Lösungen sind unterschiedlich; Daher müssen sie getrennt werden. Der häufigste Weg, sie zu trennen, ist eine Salzbrücke. In einer elektrochemischen Zelle wandelt sich die potentielle Energie der Zelle in einen elektrischen Strom um, mit dem wir eine Glühbirne anzünden oder andere elektrische Arbeiten erledigen können.
Was ist eine galvanische Zelle?
Galvanische oder Voltaische Zellen speichern elektrische Energie. Batterien werden aus einer Reihe von galvanischen Zellen hergestellt, um eine höhere Spannung zu erzeugen. Die Reaktionen an den beiden Elektroden in galvanischen Zellen neigen dazu, spontan vorzugehen. Wenn die Reaktionen stattfinden, gibt es einen Elektronenfluss von der Anode zur Kathode über einen externen Leiter.
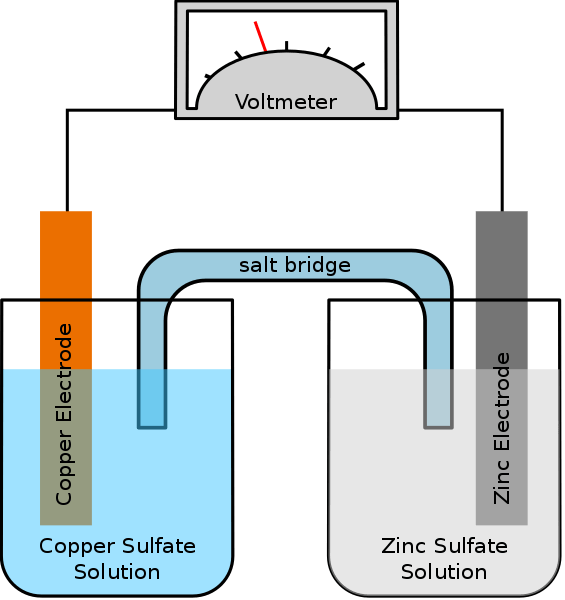
Abbildung 02: Eine galvanische Zelle
Wenn beispielsweise die beiden Elektroden Silber und Kupfer in einer galvanischen Zelle sind, ist die Silberelektrode in Bezug auf die Kupferelektrode positiv. Die Kupferelektrode ist die Anode und erfährt Oxidationsreaktion und setzt Elektronen frei. Diese Elektronen gehen über den externen Stromkreis in die Silberkathode. Daher unterliegt die Silberkathode eine Reduktionsreaktion. Zwischen den beiden Elektroden wird eine Potentialdifferenz erzeugt, die den Elektronenfluss ermöglichen. Es folgt die spontane Zellreaktion der obigen galvanischen Zelle.
2 Ag+ (aq) + cu (s) ⇌ 2AG (s) + cu2+ (aq)
Was ist der Unterschied zwischen elektrochemischer Zelle und galvanischer Zelle?
Es gibt zwei Arten von elektrochemischen Zellen als elektrolytische Zellen und galvanische Zellen. Der Schlüsselunterschied zwischen elektrochemischer Zell und galvanischer Zelle besteht darin, dass die meisten elektrochemischen Zellen dazu neigen, elektrische Energie in chemische Energie umzuwandeln, während galvanische Zellen dazu neigen, chemische Energie in elektrische Energie umzuwandeln. Darüber hinaus ist die Anode in den meisten elektrochemischen Zellen wie elektrolytischen Zellen der positive Anschluss, während die Kathode der negative Anschluss ist; In der galvanischen Zelle ist die Anode jedoch der negative Anschluss und die Kathode ist das positive Anschluss.
Darüber hinaus besteht ein weiterer Unterschied zwischen elektrochemischer Zell und galvanischer Zelle darin, dass in elektrochemischen Zellen wie elektrolytischen Zellen nicht spontane chemische Reaktionen stattfinden, aber in galvanischen Zellen treten spontane chemische Reaktionen auf.
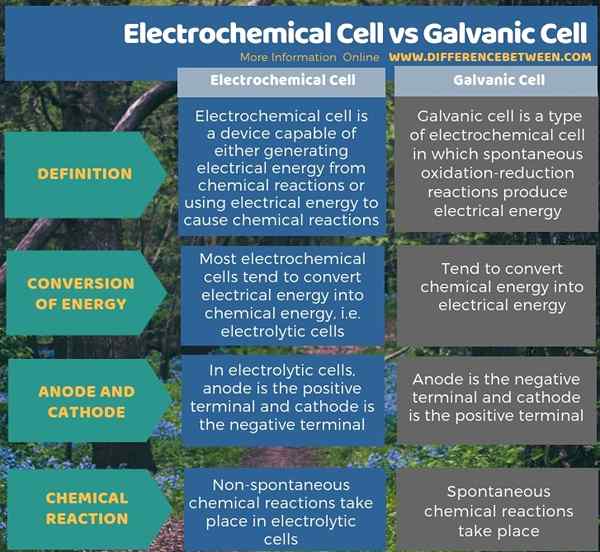
Zusammenfassung -Elektrochemische VS und galvanische Zelle
Es gibt zwei Arten von elektrochemischen Zellen als elektrolytische Zellen und galvanische Zellen. Der Schlüsselunterschied zwischen elektrochemischer Zell und galvanischer Zelle besteht darin, dass die meisten elektrochemischen Zellen dazu neigen, elektrische Energie in chemische Energie umzuwandeln, während galvanische Zellen dazu neigen, chemische Energie in elektrische Energie umzuwandeln.
Referenz:
1.„Elektrochemische Zelle.” Elektrochemische Zelle - Ein Überblick | Sciencedirect -Themen, Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Electrochemcel" von Alksub bei der englischen Wikipedia (CC BY-SA 3.0) über Commons Wikimedia
2. "Galvanische Zelle" von Gringer - Datei: Galvanische Zelle.PNG nach Tinux (CC BY-SA 3.0) über Commons Wikimedia


