Unterschied zwischen Doppelbindung und Einzelbindung
Der Schlüsselunterschied Zwischen Doppelbindung und einzelner Bindung ist das, in einer einzigen Bindungsbildung, Zwei Atome teilen Ein Elektronenpaar nur zwischen dem WHERE, in einer Doppelbindungsbildung, teilen sich zwei Atome zwei Elektronenpaare.
Wie vom amerikanischen Chemiker G vorgeschlagen.N.Lewis, Atome sind stabil, wenn sie acht Elektronen in ihrer Valenzschale enthalten. Die meisten Atome haben weniger als acht Elektronen in ihren Valenzschalen (mit Ausnahme der edlen Gase in Gruppe 18 des Periodenzüchtertabels); Daher sind sie nicht stabil. Diese Atome reagieren dazu, miteinander zu reagieren, stabil zu werden. Somit kann jedes Atom eine edle -gas elektronische Konfiguration erreichen. Und dies kann durch Bildung von ionischen Bindungen, kovalenten Bindungen oder metallischen Bindungen passieren. Unter diesen ist die kovalente Bindung etwas Besonderes. Einzel- und Doppelbindungen werden in diese Kategorie von Anleihen kommen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Doppelbindung
3. Was ist eine einzelne Bindung
4. Seite für Seitenvergleich - Doppelbindung gegen Einzelbindung in tabellarischer Form
5. Zusammenfassung
Was ist Doppelbindung?
Doppelbindungsformen, wenn zwei Atome zwei Elektronenpaare zwischen sich teilen, um die Valenzorbitale zu füllen. Doppelbindungen sind kürzer als die einzelnen Bindungen, aber stärker als sie. Sp2 Hybridisierung ermöglicht es den Atomen, Doppelbindungen zu bilden.
Doppelbindungen können von zwei Arten sein. Von den beiden Bindungen ist einer eine Sigma -Bindung. Es bildet sich über die lineare Überlappung von zwei SP2 Hybridisierte Orbitale. Zweitens bildet sich die andere Bindung (die wir als PI -Bond nennen) über die laterale Überlappung von zwei P -Orbitalen.
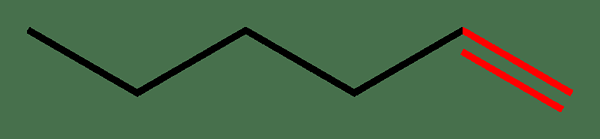
Abbildung 01: Doppelbindung in roter Farbe
Das gemeinsame Beispiel eines Moleküls mit einer Doppelbindung ist Ethylen. In Ethylen liegt die Doppelbindung zwischen zwei Kohlenstoffatomen. Abgesehen von ähnlichen Atomen kann sich diese Art von Bindungen jedoch auch zwischen verschiedenen Atomen bilden, wie in den Beispielen des Carbonylkohlenstoffs (C = O), Imine (C = N), Azo -Verbindungen (n = n) usw.
Was ist eine einzelne Bindung?
Einzelbindung bildet sich, wenn zwei Atome mit ähnlichen oder niedrigen Elektronegativitätsdifferenz ein Elektronenpaar teilen. Diese beiden Atome können von gleichen Typen oder unterschiedlichen Typen sein. Zum Beispiel, wenn die gleiche Art von Atomen verbindet, um Moleküle wie CL zu bilden2, H2, oder p4, Jedes Atom bindet mit einem anderen durch eine einzelne kovalente Bindung.
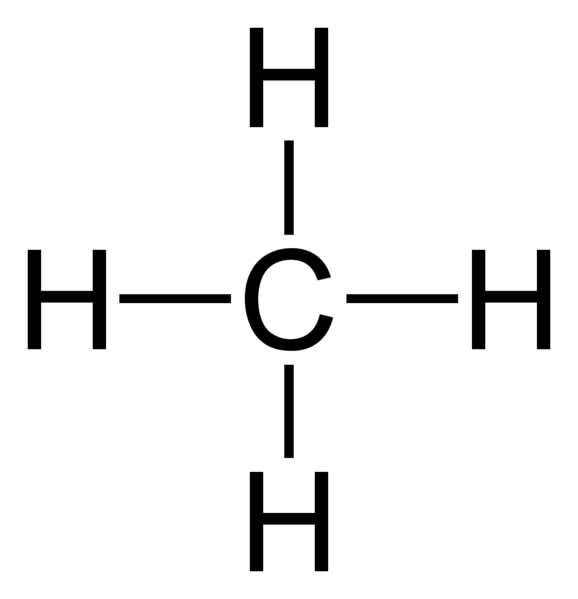
Methanmolekül (CH4) hat eine einzige kovalente Bindung zwischen zwei Arten von Elementen (Kohlenstoff- und Wasserstoffatome). Ferner ist Methan ein Beispiel für ein Molekül mit kovalenten Bindungen zwischen Atomen mit sehr geringem Elektronegativitätsunterschied.

Abbildung 02: Struktur des Methanmoleküls
Wir nennen einzelne kovalente Bindungen auch als Sigma -Bindungen. Eine einzelne Bindung gibt einem Molekül die Fähigkeit, sich um diese Bindung um einander zu drehen. Daher ermöglicht diese Rotation ein Molekül, unterschiedliche Konformationsstrukturen zu haben. Auch diese Art von Bindungen bildet sich mit SP3 hybridisierte Atome eines Moleküls. Wenn zwei gleich sp3 Hybridisierte Moleküle linear überlappen, eine einzelne Bindungsformen.
Was ist der Unterschied zwischen Doppelbindung und Einzelbindung??
Kovalente Bindungen bestehen hauptsächlich von drei Arten; Einzelbindungen, Doppelbindungen und dreifache Bindungen. Der Schlüsselunterschied zwischen Doppelbindung und Einzelbindung besteht darin, dass in einer einzelnen Bindungsbildung nur ein Elektronenpaar zwischen zwei Atomen geteilt wird, während in einer Doppelbindungsbildung zwei Elektronenpaare geteilt werden.
Darüber hinaus besteht ein wesentlicher Unterschied zwischen Doppelbindung und Einzelbindung darin, dass die einzelne Bindung durch Überlappung von zwei SP3 -hybridisierten Orbitalen resultiert.
Abgesehen davon enthält eine einzelne Bindung eine Sigma -Bindung, während eine Doppelbindung eine Sigma -Bindung und eine PI -Bindung enthält. Dies beeinflusst daher die Bindungslänge zwischen Atomen. Dies führt daher zu einem weiteren Unterschied zwischen Doppelbindung und einzelner Bindung. Das ist; Die Länge einer einzelnen Bindung ist höher als die einer Doppelbindung. Darüber hinaus ist die Doppelbindungsdissoziationsenergie relativ höher als die Dissoziationsenergie der einzelnen Bindungen.
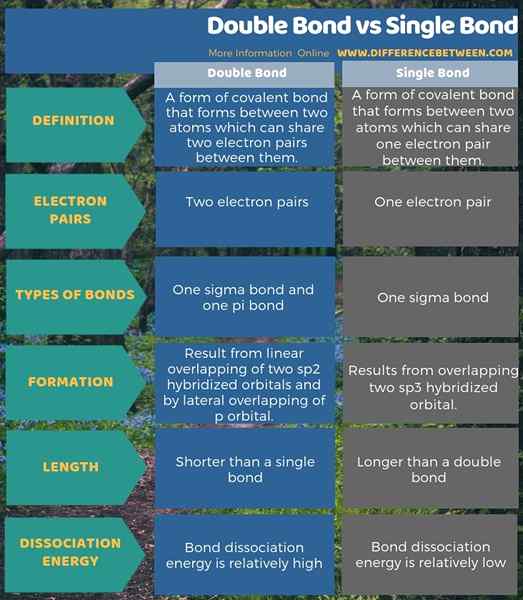
Zusammenfassung -Doppelbindung gegen Einzelbindung
Doppelbindungen und einzelne Bindungen sind Arten von kovalenten chemischen Bindungen. Der Schlüsselunterschied zwischen Doppelbindung und Einzelbindung besteht darin, dass in einer einzelnen Bindungsbildung nur ein Elektronenpaar zwischen zwei Atomen geteilt wird, während in einer Doppelbindungsbildung zwei Elektronenpaare geteilt werden.
Referenz:
1. Helmenstine, Anne Marie, ph.D. „Doppelbindungsdefinition und Beispiele in der Chemie.”Thoughtco, dec. 5, 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Skelettformulae-terminal-Double-Bindungen” (Public Domain) über Commons Wikimedia
2."Methan-2D-Quadrat" (Public Domain) über Commons Wikimedia


