Unterschied zwischen Elektronenaffinität und Elektronengewinnenthalpie
Der Schlüsselunterschied Zwischen Elektronenaffinität und Elektronengewinnenthalpie ist das Elektronenaffinität bezieht sich auf die Tendenz eines isolierten Atoms, ein Elektron zu erhalten, während die Elektronengewinnenthalpie die Energie ist.
Elektronenaffinität und Elektronengewinnenthalpie sind zwei verwandte Begriffe, da die Elektronengewinnenthalpie eine Messung in Bezug auf die Elektronenaffinität darstellt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist die Elektronenaffinität
3. Was ist Elektronengewinnenthalpie
4. Seite für Seitenvergleich - Elektronenaffinität gegen Elektronengewinnenthalpie in tabellarischer Form
5. Zusammenfassung
Was ist die Elektronenaffinität?
Die Elektronenaffinität ist die Menge an Energie, die freigesetzt wird, wenn ein neutrales Atom oder ein Molekül (in der gasförmigen Phase) ein Elektron von außen erhält. Dieser Prozess des Elektronengewinns kann die Bildung einer negativ geladenen chemischen Spezies verursachen.
Darüber hinaus fördert die Zugabe eines Elektrons zu einem neutralen Atom oder eines Moleküls Energie. Wir können dies als exotherme Reaktion bezeichnen. Diese Art von Reaktion führt zu einem negativen Ion. Wenn jedoch ein anderes Elektron zu diesem negativen Ion hinzugefügt wird, sollte Energie verabreicht werden, um mit dieser Reaktion fortzufahren. Dies liegt daran, dass das eingehende Elektron von anderen Elektronen abgestoßen wird. Dieses Phänomen wird als endotherme Reaktion bezeichnet.

Die ersten Elektronenaffinitäten sind negative Werte und die zweiten Elektronenaffinitätswerte derselben Spezies sind positive Werte.
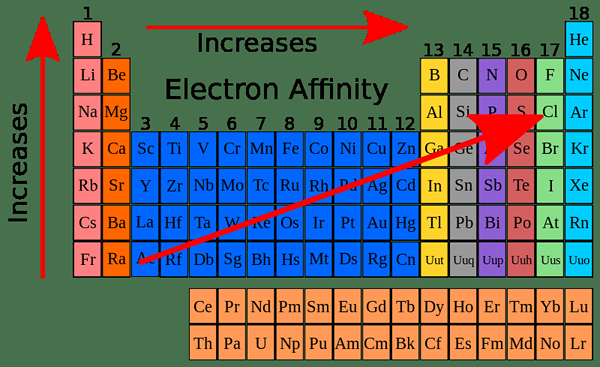
Die Elektronenaffinität zeigt eine regelmäßige Variation in der Periodenzüchtertabelle. Dies liegt daran, dass das eingehende Elektron dem äußersten Orbital eines Atoms hinzugefügt wird. Die Elemente der Periodenzüchter sind gemäß der aufsteigenden Reihenfolge ihrer Atomnummer angeordnet. Wenn die Atomzahl zunimmt, nimmt die Anzahl der Elektronen in ihren äußersten Orbitalen zu.
Im Allgemeinen sollte die Elektronenaffinität entlang des Zeitraums von links nach rechts zunehmen, da die Anzahl der Elektronen entlang eines Zeitraums zunimmt. Daher ist es schwierig, ein neues Elektron hinzuzufügen. Bei experimentell analysierter Analyse zeigen die Elektronenaffinitätswerte eher ein Zick-Zack-Muster als ein Muster, das einen allmählichen Anstieg zeigt.
Was ist Elektronengewinnenthalpie?
Elektronengewinnenthalpie ist die Änderung der Enthalpie, wenn ein neutrales Atom oder ein Molekül ein Elektron von außen erhält. Wir können sagen, es ist die Menge an Energie, die freigesetzt wird, wenn ein neutrales Atom oder ein Molekül (in der Gasphase) ein Elektron von außen erhält. Daher ist die Elektronengewinnenthalpie ein weiterer Begriff, den wir für die Elektronenaffinität verwenden. Die Einheit für die Messung der Elektronengewinnenthalpie ist kj/mol. Die neue Elektronenaddition verursacht die Bildung einer negativ geladenen chemischen Spezies.
Es besteht jedoch eine Unterscheidung zwischen Elektronengewinnenthalpie und Elektronenaffinität. Elektronengewinnenthalpie repräsentiert die Energie, die in die Umgebung freigesetzt wird, wenn ein Elektron gewonnen wird, während die Elektronenaffinität die von der Umgebung absorbierte Energie darstellt. Daher ist die Enthalpie der Elektronengewinnung ein negativer Wert, während die Elektronenaffinität ein positiver Wert ist. Grundsätzlich repräsentieren beide Begriffe den gleichen chemischen Prozess.
Die Elektronengewinnenthalpie gibt uns eine Vorstellung davon, wie stark ein Elektron an ein Atom gebunden ist. Größer die Menge an freigesetzten Energie, größer die Elektronengewinnenthalpie.
Der Wert der Elektronengewinnenthalpie hängt von der Elektronenkonfiguration des Atoms ab, an das ein Elektron gewonnen wird. Die Zugabe eines Elektrons zu einem neutralen Atom oder eines Moleküls fördert Energie. Dies wird als exotherme Reaktion bezeichnet. Diese Reaktion führt zu einem negativen Ion. Elektronengewinnenthalpie ist ein negativer Wert. Wenn jedoch ein anderes Elektron zu diesem negativen Ion hinzugefügt wird, sollte Energie verabreicht werden, um mit dieser Reaktion fortzufahren. Dies liegt daran, dass das eingehende Elektron von den anderen Elektronen abgestoßen wird. Dieses Phänomen wird als endotherme Reaktion bezeichnet. Hier ist die Elektronengewinnenthalpie ein positiver Wert.
Was ist der Unterschied zwischen Elektronenaffinität und Elektronengewinnenthalpie?
Die Elektronenaffinität ist die Menge an Energie, die freigesetzt wird, wenn ein neutrales Atom oder ein Molekül (in der gasförmigen Phase) ein Elektron von außen erhält. Elektronengewinnenthalpie ist die Änderung der Enthalpie, wenn ein neutrales Atom oder ein Molekül ein Elektron von außen erhält. Der Hauptunterschied zwischen Elektronenaffinität und Elektronengewinnenthalpie besteht darin, dass sich die Elektronenaffinität auf die Tendenz eines isolierten Atoms bezieht, ein Elektron.
Nachfolgend finden Sie eine Zusammenfassung der Differenz zwischen Elektronenaffinität und Elektronengewinnenthalpie in tabellarischer Form.
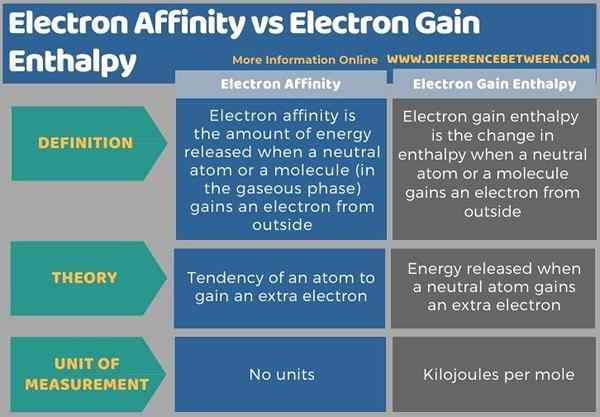
Zusammenfassung -Elektronenaffinität gegen Elektronengewinnenthalpie
Elektronenaffinität und Elektronengewinnenthalpie sind zwei verwandte Begriffe, da die Elektronengewinnenthalpie eine Messung in Bezug auf die Elektronenaffinität darstellt. Der wichtigste Unterschied zwischen Elektronenaffinität und Elektronengewinnenthalpie besteht darin, dass die Elektronenaffinität auf die Tendenz eines isolierten Atoms zum Erhalten eines Elektrons bezieht, während die Elektronengewinnenthalpie die Energie ist.
Referenz:
1. "Elektronenaffinität.” Chemie -Libretexten, Libretexten, 26. September. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Elektronenaffinitätszeitraum" von CDang und Adrignola (CC BY-SA 3.0) über Commons Wikimedia


