Unterschied zwischen Elektrovaltigkeit und Kovalenz
Der Schlüsselunterschied zwischen Elektrovalenz und Kovalenz ist, dass die Elektrovalenz ist die Anzahl der Elektronen, die ein Atom entweder zu Gewinne oder Verluste bei der Bildung eines Ion.
Obwohl die Begriffe Elektrovaltigkeit und Kovalenz ähnlich klingen, unterscheiden sie sich je nach ihren Definitionen voneinander. Hauptsächlich erklärt die Elektrovalenz die Bildung eines Ions, während die Kovalenz die Bildung einer kovalenten Bindung erklärt.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Elektrovalenz
3. Was ist Kovalenz
4. Seite an Seite Vergleich - Elektrovalenz gegen Kovalenz in tabellarischer Form
5. Zusammenfassung
Was ist Elektrovalenz?
Elektrovaltigkeit ist die Anzahl der Elektronen, die während der Bildung eines Ions aus diesem Atom gewonnen oder verloren haben. Daher bezieht es sich auf die Anzahl der Elektronen, die ein Atom entweder zugenommen oder Verluste bei der Bildung einer elektrisch. Nach dieser Erklärung ergibt es die elektrische Netto -Ladung eines Ions. Wenn ein Atom bei der Bildung einer Ionenbindung Elektronen verliert. Die Verbindungen mit Atomen mit Elektrovalenz sind ionische Verbindungen.

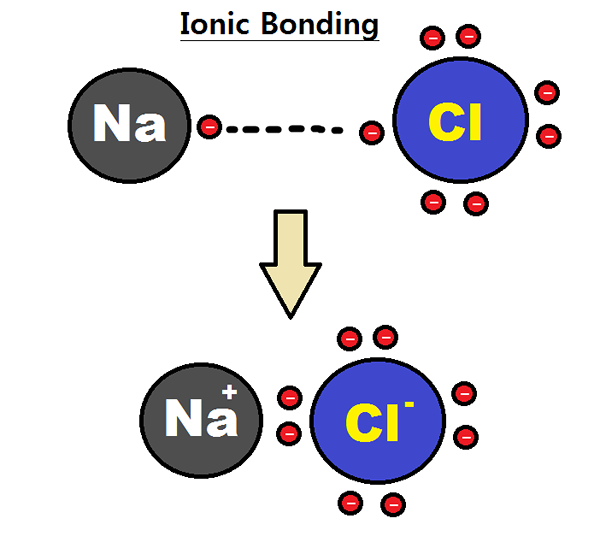
Abbildung 01: Bildung einer ionischen Bindung
Betrachten wir beispielsweise die Bildung von Natriumchlorid (NaCl). Dort verliert das Natriumatom ein Elektron; Somit hat es eine positive Elektrovalenz. Das Chloratom erhält dieses Elektron. Somit hat es eine negative Elektrovalenz. Da die Anzahl der verlorenen oder gewonnenen Elektronen jedoch eins ist, ist die Elektrovalenz von Natrium (oder Chlor) eins. Wir sollten die Elektrovalenz mit dem entsprechenden Seufzer geben, um anzugeben, ob es sich um eine positive oder negative Elektrovalenz handelt.
- Natrium = positive Elektrovalenz -Natrium kann als +1 angegeben werden.
- Chlor = negative Elektrovalenz von Chlor kann als -1 angegeben werden.
Was ist Kovalenz?
Kovalenz ist die maximale Anzahl von Elektronen, die sie mit einem anderen Atom teilen kann. Daher zeigt es die maximale Anzahl kovalenter Bindungen an, die sich ein Atom unter Verwendung seiner leeren Orbitale bilden kann. Der Wert dieses Parameters hängt von der Anzahl der Valenzelektronen eines Atoms und der Anzahl der in einem Atom vorhandenen leeren Orbitale ab.
Zum Beispiel hat ein Wasserstoffatom nur ein Elektron; Somit kann es ein Elektron mit einem anderen Atom teilen. Daher beträgt die Kovalenz von Wasserstoff 1. Im Gegensatz zur Elektrovalenz benötigen wir keine Plus- oder Minus -Anzeichen, da es keinen Verlust oder keine Elektronengewinn gibt. Nur die Elektronen werden miteinander geteilt.
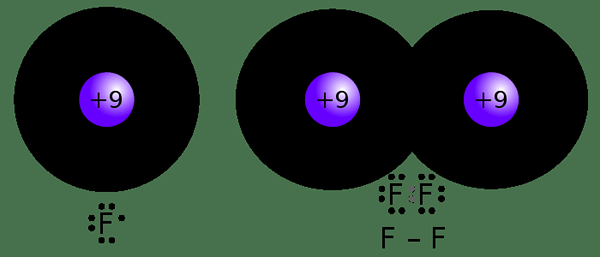
Abbildung 02: Bildung einer kovalenten Bindung
Wie oben erwähnt, ist nicht nur die Anzahl der Valenzelektronen, sondern auch die Anzahl der leeren Orbitale eines Atoms wichtig für die Bestimmung der Kovalenz. Wenn wir beispielsweise Kohlenstoff als Beispiel betrachten, hat es 4 Elektronen in der äußersten Elektronenschale. Dort hat es die 2s22p2 Elektronenkonfiguration. Daher gibt es ein leeres 2p -Orbital. Daher können sich die beiden gepaarten Elektronen im 2S -Orbital trennen, und ein Elektron wird in das leere 2p -Orbital enthalten. Dann gibt es 4 ungepaarte Elektronen. Carbon kann alle vier Elektronen mit einem anderen Atom teilen. Daher wird die Kovalenz von 4. Dies liegt daran.
Was ist der Unterschied zwischen Elektrovaltigkeit und Kovalenz?
Elektrovaltigkeit ist die Anzahl der Elektronen, die während der Bildung eines Ions aus diesem Atom gewonnen oder verloren haben. Es erklärt die Bildung einer ionischen Bindung. Darüber hinaus sind die Verbindungen mit Atomen mit diesem Parameter ionische Verbindungen. Die Kovalenz hingegen ist die maximale Anzahl von Elektronen, die sie mit einem anderen Atom teilen kann. Es erklärt die Bildung einer kovalenten Bindung. Zusätzlich sind die Verbindungen mit Atomen mit einer Kovalenz kovalente Verbindungen.
Die folgende Infografik zeigt den Unterschied zwischen Elektrovaltigkeit und Kovalenz in tabellarischer Form.

Zusammenfassung -Elektrovalenz gegen Kovalenz
Obwohl die Begriffe Elektrovaltigkeit und Kovalenz ähnlich klingen, haben sie unterschiedliche Definitionen und Eigenschaften. Der Unterschied zwischen Elektrovalenz und Kovalenz besteht darin, dass die Elektrovalenz die Anzahl der Elektronen ist, dass ein Atom entweder zugenommen oder Verluste bei der Bildung eines Ions bildet.
Referenz:
1. “2. Grundidee der Bindung.Rolle des pH -Werts in der Alltagschemie. Hier verfügbar
2. „Chemiekalenz und molekulare Strukturen.”Biologie-nervöser Systemreaktionszeitforschung. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Ionicbondingrh11" von Rhannosh - eigene Arbeit (CC BY -SA 3).0) über Commons Wikimedia
2.”Kovalenter Bindungsfluor“ von Jacek FH - eigene Arbeit (CC BY -SA 3).0) über Commons Wikimedia


