Unterschied zwischen Anregung und Ionisierungspotential
Schlüsselunterschied - Anregung gegen Ionisierungspotential
Die beiden Begriffe Anregungspotential und Ionisationspotential hängen mit der Energie zusammen, die für die Verschiebung der Elektronen erforderlich ist. Es gibt jedoch einen Unterschied zwischen ihnen basierend auf dem Ziel der Elektronenbewegung. Mit anderen Worten, in diesen beiden Situationen ist das Ziel des Elektrons nach der Bewegung anders. Auf diese Weise können zwei Bewegungen von Elektronen identifiziert werden. Elektronen können sich entweder auf ein höheres Energieniveau innerhalb des Atoms oder des Moleküls bewegen oder sich vom Kern lösen und sich vom Atom entfernen. Beide Prozesse erfordern bestimmte Energiemengen. Elektronen können sich nur bewegen, wenn die erforderliche Energie nicht absorbiert wird. Der Schlüsselunterschied Zwischen Erregung und Ionisationspotential ist das Anregungspotential ist die Energie, die erforderlich ist, um von einem Energieniveau zu einem anderen zu springen während Ionisierungspotential ist die Energie, die erforderlich ist, um ein Elektron aus einem Atom zu entfernen.
Was ist Anregungspotential?
Atome haben Energieniveaus, die als Umlaufbahnen bezeichnet werden. Elektronen bewegen sich in diesen Umlaufbahnen um den Kern. Elektronen können keine willkürlichen Umlaufbahnen wählen. Sie werden nach ihrem Energieniveau in bestimmte Umlaufbahnen platziert und sind darauf beschränkt, sich zu bewegen oder auf einen anderen Energieniveau zu springen, es sei denn, sie absorbieren die erforderliche Menge an Energie. Der Wechsel von einer Umlaufbahn zur anderen nach Absorption der erforderlichen Energie wird als Anregung bezeichnet, und die Energie, die von einer Umlaufbahn zum anderen absorbiert wird, wird als Anregungspotential bezeichnet oder Anregungsenergie. 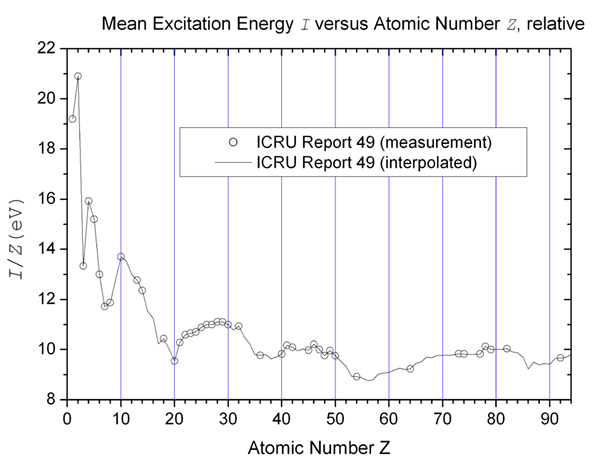
Was ist Ionisationspotential?
Ionisation ist das Entfernen eines Elektrons aus der Valenzschale. Im Allgemeinen werden Elektronen durch starke elektrostatische Kräfte an den Kern gebunden. Daher ist Energie erforderlich, um ein Elektron vollständig aus dem Atom zu entfernen. Dies ist definiert als das Entfernen eines Elektrons aus Atom oder Molekül in unendlicher Entfernung. Die für diesen Prozess erforderliche Energie heißt “,“Ionisationsenergie"Oder" Ionisierungspotential ".
Mit anderen Worten, es ist die Potentialdifferenz zwischen dem Anfangszustand, in dem Elektron an den Kern begrenzt ist.

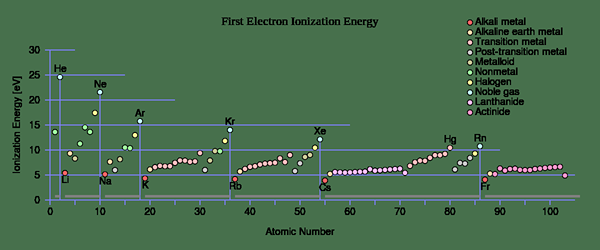
Periodische Trends zur Ionisierungsenergie (dh) vs. Protonennummer
Was ist der Unterschied zwischen Erregung und Ionisierungspotential?
Definition von Anregung und Ionisierungspotential
Anregungspotential:
Die Energie, die von einem Elektron absorbiert wird, um von einem Energieniveau zu einem höheren Energieniveau zu wechseln, wird als „Anregungspotential“ oder Anregungsenergie bezeichnet. Dies ist normalerweise der Energieunterschied zwischen anfänglichem und endgültigem Zustand.
Hinweis: Elektron bewegt sich im Atom, jedoch in unterschiedlichen Energieniveaus.
Ionisierungspotential:
Die Energie, die erforderlich ist, um ein Elektron aus einem Atom zu entfernen, heißt „Ionisierungspotential“ oder “Ionisationsenergie”. Dies ist die Potentialdifferenz zwischen zwei Zuständen, in denen ein Elektron an den Kern begrenzt ist und das Elektron aus dem Atom entfernt wird. Die Energie, wenn sich das Elektron in einem unendlichen Abstand befindet, wird als Null betrachtet.
Hinweis: Ein Elektron wird aus dem Atom entfernt und es gibt keine Anziehungskraft mit dem Kern, wenn es entfernt wird.
Berechnung:
Anregungspotential:
Wenn ein Elektron vom Grundzustand (n = 1) zu einem anderen (n = 2) Energieniveau springt, wird die entsprechende Energie 1 genanntst Anregungspotential.
| 1st Anregungspotential = Energie (n = 2 Level) - Energie (n = 1 Stufe) = -3.4 ev - (-13.6 ev) = 10.2 ev |
Wenn ein Elektron vom Grundzustand (n = 1) zu einem anderen (n = 3) Energieniveau springt, wird die entsprechende Energie als 2. Anregungspotential bezeichnet.
| 2nd Anregungspotential = Energie (n = 3 Ebene) - Energie (n = 1 Stufe) = -1.5 ev - (-13.6 ev) = 12.1 ev |
Ionisierungspotential:
Erwägen Sie, ein Elektron aus n = 1 Energieniveau zu entfernen. Das Ionisierungspotential ist Energie, die erforderlich ist, um ein Elektron von n = 1 Niveau bis unendlich zu entfernen.
| Ionisierungspotential = e Unendlichkeit - E (n = 1 Stufe)= 0 - (-13.6 ev) = 13.6 ev |
Bei Atomen werden die am stärksten gebundensten Elektronen zuerst entfernt und das Ionisierungspotential steigt allmählich an, wenn es ionisiert.
Bild mit freundlicher Genehmigung:
“Mittleres Anregungspotential “von HPaul - eigene Arbeit. (Public Domain) über Wikimedia Commons
"Erste Ionisierungsenergie" von Benutzer: Sponk (CC BY-SA 3.0) über Commons


