Unterschied zwischen Reaktionen erster und zweiter Ordnung
Der Schlüsselunterschied Zwischen den Reaktionen des ersten und zweiten Ordnungs ist das Die Geschwindigkeit der Reaktionen erster Ordnung hängt von der ersten Leistung der Reaktantenkonzentration in der Geschwindigkeitsgleichung ab, während die Geschwindigkeit der Reaktionen zweiter Ordnung von der zweiten Leistung des Konzentrationsterms in der Geschwindigkeitsgleichung abhängt.
Die Reihenfolge einer Reaktion ist die Summe der Mächte, auf die die Reaktantenkonzentrationen in der Geschwindigkeitsrechtsgleichung erhöht werden. Es gibt verschiedene Formen von Reaktionen nach dieser Definition; Reaktionen von Null Ordnung (diese Reaktionen hängen nicht von der Konzentration von Reaktanten ab), Reaktionen erster Ordnung und Reaktionen zweiter Ordnung.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Reaktionen erster Ordnung
3. Was sind Reaktionen zweiter Ordnung
4. Seite für Seitenvergleich - Erste gegen Reaktionen zweiter Ordnung in tabellarischer Form
5. Zusammenfassung
Was sind Reaktionen erster Ordnung?
Reaktionen erster Ordnung sind chemische Reaktionen, von denen die Reaktionsgeschwindigkeit von der molaren Konzentration eines der Reaktanten abhängt, die an der Reaktion beteiligt sind. Daher wird nach der obigen Definition für die Reaktionsreihenfolge die Summe der Befugnisse, auf die die Reaktantenkonzentrationen in der Rate Law -Gleichung erhöht werden, immer 1 sein. Es kann entweder einen einzelnen Reaktanten geben, der an diesen Reaktionen teilnimmt. Dann bestimmt die Konzentration dieses Reaktanten die Reaktionsgeschwindigkeit. Aber manchmal gibt es mehr als einen Reaktanten, die an diesen Reaktionen teilnehmen, dann bestimmt einer dieser Reaktanten die Reaktionsgeschwindigkeit.
Betrachten wir ein Beispiel, um dieses Konzept zu verstehen. In der Zersetzungsreaktion von n2Ö5, Es bildet Nr2 und o2 Gase als Produkte. Da es nur einen Reaktanten hat, können wir die Reaktion und die Geschwindigkeitsgleichung wie folgt schreiben.
2n2Ö5 (g) → 4no2 (g) + Ö2 (g)
Rate = k [n2Ö5 (g)]M
Hier ist K die Geschwindigkeitskonstante für diese Reaktion und m ist die Reihenfolge der Reaktion. Daher beträgt der Wert von m aus experimentellen Bestimmungen 1. Dies ist also eine Reaktion erster Ordnung.
Was sind Reaktionen zweiter Ordnung?
Reaktionen zweiter Ordnung sind chemische Reaktionen, von denen die Reaktionsgeschwindigkeit von der molaren Konzentration von zwei der Reaktanten oder der zweiten Leistung eines Reaktanten abhängt, der an der Reaktion beteiligt ist. Daher wird nach der obigen Definition für die Reaktionsreihenfolge die Summe der Befugnisse, auf die die Reaktantenkonzentrationen in der Geschwindigkeitsrechtsgleichung erhöht werden, immer 2 sein. Wenn es zwei Reaktanten gibt, hängt die Reaktionsgeschwindigkeit von der ersten Leistung der Konzentration jedes Reaktanten ab.

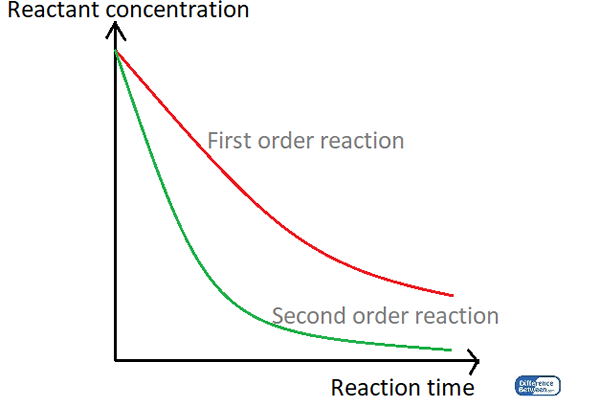
Abbildung 01: Ein Diagramm, in dem die beiden Reaktionstypen mit ihrer Reaktionszeit und der Reaktantenkonzentration verglichen werden.
Wenn wir die Konzentration eines Reaktanten um das 2 -fache erhöhen (wenn zwei Reaktanten in der Geschwindigkeitsgleichung vorhanden sind), nimmt die Reaktionsgeschwindigkeit um das 4 -fache zu. Betrachten wir beispielsweise die folgende Reaktion.
2a → p
Hier ist A ein Reaktant und P ist das Produkt. Wenn dies eine Reaktion zweiter Ordnung ist, lautet die Geschwindigkeitsgleichung für diese Reaktion wie folgt.
Rate = k [a]2
Aber für eine Reaktion mit zwei verschiedenen Reaktanten wie folgt;
A +b → p
Rate = k [a]1[B]1
Was ist der Unterschied zwischen Reaktionen erster und zweiter Ordnung?
Reaktionen erster Ordnung sind chemische Reaktionen, von denen die Reaktionsgeschwindigkeit von der molaren Konzentration eines der Reaktanten abhängt, die an der Reaktion beteiligt sind. Wenn wir die Reaktantkonzentration um das 2 -fache erhöhen, nimmt die Reaktionsgeschwindigkeit um das 2 -fache zu. Reaktionen zweiter Ordnung sind chemische Reaktionen, von denen die Reaktionsgeschwindigkeit von der molaren Konzentration von zwei der Reaktanten oder der zweiten Leistung eines Reaktanten abhängt, der an der Reaktion beteiligt ist. Wenn wir die Reaktantkonzentration um das 2 -fache erhöhen, nimmt die Reaktionsgeschwindigkeit um das 4 -fache zu. Die folgende Infografik zeigt den Unterschied zwischen Reaktionen erster und zweiter Ordnung in tabellarischer Form.

Zusammenfassung -Erste gegen Reaktionen zweiter Ordnung
Es gibt drei Haupttypen von Reaktionen gemäß der Reihenfolge der Reaktion; Reaktionen null Ordnung, Erste Ordnung und zweite Ordnung. Der Schlüsselunterschied zwischen Reaktionen in erster und zweiter Ordnung besteht darin, dass die Geschwindigkeit einer Reaktion erster Ordnung von der ersten Leistung der Reaktantenkonzentration in der Geschwindigkeitsgleichung abhängt, während die Geschwindigkeit einer Reaktion zweiter Ordnung von der zweiten Leistung des Konzentrationsterms in der abhängt Ratengleichung.
Referenz:
1. Libretexten. „Methoden zur Bestimmung der Reaktionsordnung.”Chemistry Libretexten, Libretexte, 5. Juni 2017. Hier verfügbar


