Unterschied zwischen Formeleinheitsmasse und Molekularmasse
Schlüsselunterschied - Formel Einheitsmasse gegen molekulare Masse
Formeleinheit Masse oder Formelmasse einer Verbindung ist die Masse der empirischen Formel dieser Verbindung. Die empirische Formel einer Verbindung ist die chemische Formel, die das Verhältnis zwischen verschiedenen Atomen in dieser Verbindung in kleinen, ganzen Zahlen ergibt. Mit anderen Worten, es ist das geringste Verhältnis zwischen chemischen Elementen in einer Verbindung. Es gibt nicht die tatsächliche Anzahl jedes chemischen Elements an. Wenn die Masse dieser Formel gemessen wird, ist sie als Formel -Einheitsmasse bekannt. Die Molekülmasse einer Verbindung ist die Masse eines Moleküls einer bestimmten Substanz. Meistens werden die Begriffe Molmasse und Molekularmasse austauschbar verwendet, obwohl sie unterschiedliche Begriffe sind. Molmasse ist die Masse eines Maulwurfs der Substanz, während die Molekülmasse nicht die Masse eines Maulwurfs einer Substanz ist. Für einfache Moleküle sind die Formelmasse und die Molekülmasse gleich. Für komplexe Verbindungen gibt es jedoch einen großen Unterschied zwischen zwei Werten. Der Schlüsselunterschied Zwischen der Formel -Einheitsmasse und der molekularen Masse ist das Der Wert der Formel -Einheitsmasse ist immer kleiner oder ähnlich der Molekülmasse derselben Substanz, während der Wert der Molekülmasse immer größer oder ähnlich der Formel -Einheitsmasse derselben Substanz ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Formeleinheit Masse
3. Was ist molekulare Masse
4. Ähnlichkeiten zwischen der Formel -Einheitsmasse und der molekularen Masse
5. Seite für Seitenvergleich - Formeleinheit Masse gegen Molekülmasse in tabellarischer Form
6. Zusammenfassung
Was ist Formeleinheit Masse?
Formeleinheit Masse oder Formelmasse ist die Masse der empirischen Formel einer bestimmten Substanz. Dies bedeutet, es ist die Summe der Atommassen der in der empirischen Formel vorhandenen chemischen Elemente. Die empirische Formel ist die chemische Formel einer Substanz, die das einfachste Verhältnis zwischen chemischen Elementen in einer Substanz ergibt. Zum Beispiel die empirische Formel für c6H12Ö6 (Glukose) ist ch2Ö. Betrachten wir einige Beispiele, um das Konzept zu verstehen.
Berechnung der Formel -Einheitsmasse
Formeleinheit Masse einfacher Verbindungen
Für einfache Verbindungen wie NaCl (Natriumchlorid) sind die empirische Formel und die molekulare Formel gleich. Der Wert der Formel -Einheitsmasse ist,
(Atommasse von Na) + (Atommasse von Cl) = (23 + 35).5) AMU = 58.5 Amu
Formeleinheit Masse komplexer Verbindungen
Für komplexe Verbindungen wie C11H22Ö11 (Saccharose), die empirische Formel ist ch2 Dann ist die Formeleinheit Masse,
(Atommasse von c) + 2 (Atommasse von H) + (Atommasse von O) = (12 + 2 × 1 + 16) Amu = 30 Amu.
Für Polymerverbindungen ist die Masse der Formeleinheit die Masse einer sich wiederholenden Einheit. Ein Polymer ist ein Makromolekül, das aus vielen kleinen Verbindungen besteht, die als Monomere bekannt sind. Eine sich wiederholende Einheit repräsentiert das Monomer oder die Monomere, die zur Herstellung der Polymerverbindung verwendet werden. Daher entspricht es der empirischen Formel einer komplexen Verbindung.
Was ist molekulare Masse?
Molekülmasse ist die Masse eines Moleküls einer bestimmten Substanz. Es ist auch als Molekulargewicht bekannt. Das Molekulargewicht wird als Summe der Atommasse aller im Molekül vorhandenen chemischen Elemente berechnet, unter Berücksichtigung der tatsächlichen Verhältnisse zwischen diesen Elementen.
Daher ist für große, komplexe Verbindungen der Wert der Formel -Einheitsmasse immer größer als der der Molekülmasse. Aber für kleine, einfache Moleküle können beide gleich sein.
Berechnung der molekularen Masse
Betrachten wir einige Beispiele, um die Berechnungsmethode zu verstehen.
Beispiel: Glukose
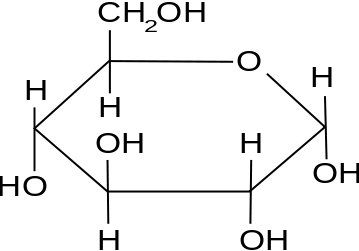
Die chemische Formel von Glukose ist c6H12Ö6. Daher ist das Molekulargewicht von Glukose,
6 (Atommasse von C) + 12 (Atommasse von H) + 6 (Atommasse von O)
= 6 (12 Amu) + 12 (1 Amu) + 6 (16 Amu)
= (72 + 12 + 96) amu
= 180 Amu.

Abbildung 01: Glukosemolekül
Beispiel: Calciumcarbonat
Die chemische Formel von Calciumcarbonat ist Caco3 , Das ist auch die empirische Formel dieser Verbindung. Daher ist das Molekulargewicht von Calciumcarbonat,
(Atommasse von Ca) + (Atommasse von C) + 3 (Atommasse von O)
= (40 + 12 + 3 x 16) amu
= 100 AMU
Was sind die Ähnlichkeiten zwischen der Masse der Formeleinheit und der molekularen Masse?
- Sowohl Formeleinheitsmasse als auch Molekülmasse sind Gewichtsmessungen von Substanzen.
- Sowohl Formeleinheitsmasse als auch Molekülmasse haben die gleiche Messeinheit.
Was ist der Unterschied zwischen der Masse der Formeleinheit und der molekularen Masse?
Formel -Einheitsmasse gegen molekulare Masse | |
| Formeleinheit Masse oder Formelmasse ist die Masse der empirischen Formel einer bestimmten Substanz. | Molekülmasse ist die Masse eines Moleküls in einer bestimmten Substanz. |
| Wert | |
| Der Wert der Formeleinheitsmasse ist immer kleiner oder ähnlich der Molekülmasse derselben Substanz. | Der Wert der molekularen Masse ist immer größer oder ähnlich der Formel -Einheitsmasse derselben Substanz. |
Zusammenfassung -Formel Einheitsmasse gegen molekulare Masse
Formel -Einheitsmasse ist die Masse der empirischen Formel einer bestimmten Substanz. Die molekulare Masse einer Substanz ist die tatsächliche Masse eines Moleküls einer bestimmten Substanz. Der Unterschied zwischen der Masse der Formeleinheit und der Molekülmasse besteht darin, dass der Wert der Formeleinheitsmasse immer kleiner oder ähnlich der Molekülmasse derselben Substanz ist, während der Wert der Molekularmasse immer größer oder ähnlich der Formel -Einheitsmasse derselben Substanz ist.
Referenz:
1.Helmenstine, Anne Marie, D. „Formelmasse gegen molekulare Masse.”Thoughtco, Mar. 25, 2017. Hier verfügbar
2."Molekulare Masse.”Wikipedia, Wikimedia Foundation, 25. Februar. 2018. Hier verfügbar
3."Empirische Formel.”Wikipedia, Wikimedia Foundation, 18. Februar. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Alpha-D-Glucose Haworth'by Masur (Public Domain) über Commons Wikimedia


