Unterschied zwischen Bildungswärme und Reaktionswärme
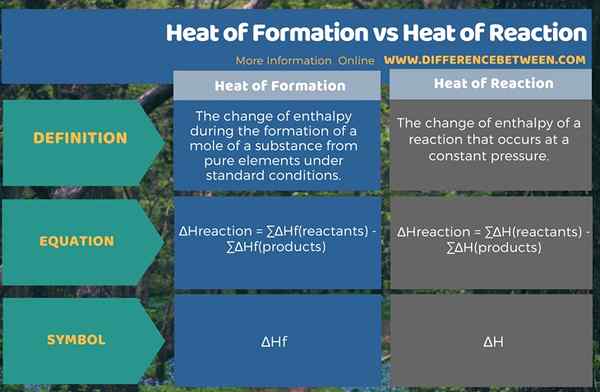
Der Schlüsselunterschied zwischen Bildungswärme und Reaktionswärme ist, dass die Bildungswärme ist die Änderung der Enthalpie während der Bildung eines Substanzmols bei Standardbedingungen, während die Reaktionswärme die Änderung der Enthalpie während einer chemischen Reaktion ist, die bei einem konstanten Druck auftritt.
Bildungswärme und Reaktionswärme sind wichtige Enthalpiewerte in Bezug auf chemische Reaktionen. Wir definieren diese Bedingungen für Standardbedingungen, ich.e. Standarddruck und Standardtemperatur. Hier ist Wärme oder Enthalpie die Energie, die entweder von einem System freigesetzt oder während der chemischen Reaktion von einem System absorbiert wird.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Formationshitze
3. Was ist Reaktionswärme
4. Seite an Seite Vergleich - Bildungswärme gegen Reaktionswärme in tabellarischer Form
5. Zusammenfassung
Was ist Formationshitze?
Bildungswärme ist die Änderung der Enthalpie während der Bildung eines Substanzmols von reinen Elementen unter Standardbedingungen. Hier sind die Standardbedingungen 1 atm Druck und 298.15 Kelvin -Temperatur. Da wir die Bildung eines Maulwurfs betrachten, ist die Einheit für diese Energie KJ/Mol. Diese Energie ist entweder die Energie, die die Bildungsreaktion freisetzt oder die Energie, die die Reaktion während des Fortschreitens verbraucht. Die Gleichung für diese Enthalpie lautet wie folgt;

Hier ist ∆ ein Symbol, das auf eine Änderung der Enthalpie hinweist, H ist die Energiemenge und F zeigt eine Formationsreaktion an. In dieser Reaktion befinden sich alle Bestandteile unter Standardbedingungen, ansonsten ist es nicht die Bildungswärme. Zum Beispiel ist die Bildung von Kohlendioxid wie folgt.
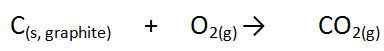
Die reine Elementarform von Kohlenstoff ist Graphit und die Sauerstoffquelle ist Diatom -Sauerstoffmolekül. Wenn wir diese Bildungsreaktion unter Standardbedingungen durchführen und die Änderung der Enthalpie messen, nennen wir sie die Form der Formation.
Was ist Reaktionswärme?
Reaktionswärme ist die Änderung der Enthalpie einer Reaktion, die bei konstantem Druck auftritt. Wir messen diesen Energieunterschied in der Einheit von kJ/mol. Es gibt die Energie, die während einer chemischen Reaktion entweder freigesetzt oder absorbiert wird. Das Symbol für diese Enthalpieänderung ist ∆H. Wenn der Wert ein positiver Wert ist, nennen wir ihn eine endotherme Reaktion. Wenn der Wert negativ ist, nennen wir es eine exotherme Reaktion. Die Gleichung für diese Enthalpieänderung ist wie folgt;
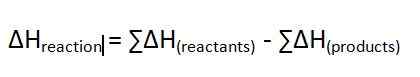
Was ist der Unterschied zwischen Bildungswärme und Reaktionswärme?
Bildungswärme ist die Änderung der Enthalpie während der Bildung eines Substanzmols von reinen Elementen unter Standardbedingungen. Das Symbol für diese Enthalpieänderung ist ∆HF. Reaktionswärme ist die Änderung der Enthalpie einer Reaktion, die bei konstantem Druck auftritt. Das Symbol für diese Enthalpieänderung ist ∆H.

Zusammenfassung -Bildungswärme gegen Reaktionswärme
Enthalpie ist der Energiegehalt. Die Änderung der Enthalpie gibt an, wie viel Energieaustausch zwischen Reaktanten, Produkten und Umgebung. Der Unterschied zwischen Bildungswärme und Reaktionswärme besteht darin ein konstanter Druck.
Referenz:
1. Libretexten. „Standardenthalpie der Bildung.”Chemie libretexten, libretexten, 9. Februar. 2017. Hier verfügbar
2. Britannica, die Herausgeber von Encyclopaedia. „Reaktionswärme.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 4 Apr. 2016. Hier verfügbar


