Unterschied zwischen Fusionswärme und Kristallisation
Der Schlüsselunterschied Zwischen Fusionswärme und Kristallisation ist das Fusionswärme bezieht sich auf die Veränderung der Energie, wenn ein fester Zustand einer bestimmten Substanz in den flüssigen Zustand umgewandelt wird, während die Kristallisation Wärme auf die Wärme bezieht, die entweder absorbiert oder entwickelt wird, wenn ein Mol einer bestimmten Substanz einer Kristallisation unterliegt.
Chemische Reaktionen treten typischerweise durch Absorption oder Freisetzung von Energie auf. Hier wird die Energie entwickelt oder hauptsächlich in Form von Wärme absorbiert. Daher kann die Energieänderung für eine bestimmte Reaktion als Wärme dieser Reaktion oder als Enthalpie dieser Reaktion bezeichnet werden.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Hitze der Fusion
3. Was ist die Kristallisationshitze
4. Seite an Seite Vergleich - Wärme der Fusion gegen Kristallisation in tabellarischer Form
5. Zusammenfassung
Was ist Hitze der Fusion?
Die Hitze der Fusion oder Enthalpie der Fusion ist die Energie, die sich während der Umwandlung der Phase eines Substanz vom Festkörperzustand in den flüssigen Zustand verändert. Typischerweise treten Energieveränderungen in Form von Wärme auf, und die Reaktion sollte in einem konstanten Druck erfolgen, um eine ordnungsgemäße Fusionswärme zu definieren. Die Erwärmungswärme ist der gleiche und entgegengesetzte Begriff für die Wärme der Fusion.
Die Wärme der Fusion ist für das Schmelzen einer Substanz definiert. Diese Energieänderung wird als latente Wärme bezeichnet, da die Temperatur während des Umwandlungsprozesses konstant bleibt. Wenn wir die Energieänderung pro Menge Substanz in Mol betrachten, kann der Begriff für diesen Prozess als Molarenwärme der Fusion angegeben werden.

Im Allgemeinen hat die flüssige Phase einer Substanz eine hohe innere Energie im Vergleich zu ihrer festen Phase, da ihre kinetische Energie höher ist als die potentielle Energie. Daher müssen wir einem Feststoff etwas Energie liefern, um ihn zu schmelzen. Im Gegensatz dazu setzt eine Substanz Energie frei, wenn eine Flüssigkeit ein Feststoff wird oder gefriert. Dies liegt hauptsächlich an den Molekülen in der Flüssigkeit auf schwächere intermolekulare Wechselwirkungen als Moleküle in der festen Phase.
Was ist die Kristallisationshitze?
Die Kristallisation Wärme oder Enthalpie der Kristallisation ist die Energie, die sich während der Kristallisation einer Substanz verändert. Kristallisation kann entweder als natürlicher Prozess oder als künstlicher Prozess auftreten. In der festen Phase einer Substanz sind die Moleküle oder Atome stark zu einer kristallinen Struktur organisiert. Wir nennen dies eine Kristallstruktur. Ein Kristall kann sich auf unterschiedliche Weise bilden, wie z.

Es gibt zwei Hauptschritte der Kristallisation: Keimbildung (eine kristalline Phase erscheint entweder in einer superkühlten Flüssigkeit oder in einem übersättigten Lösungsmittel) und Kristallwachstum (die Zunahme der Partikelgröße und führt zu einem Kristallzustand).
Was ist der Unterschied zwischen Fusionswärme und Kristallisation?
Eine chemische Reaktion tritt durch Absorption oder entwickelnde Energie in Form von Wärme auf. Die Wärme von Fusion und Kristallisation sind zwei Beispiele für diese Art von Reaktionen. Und der Hauptunterschied zwischen Fusionswärme und Kristallisation besteht darin, dass sich die Wärme der Fusion auf die Energieänderung bezieht Wenn ein Mol einer bestimmten Substanz Kristallisation unterzogen wird.
Nachfolgend finden Sie eine zusammenfassende Tabelle der Differenz zwischen Fusionswärme und Kristallisation.

Zusammenfassung -Wärme der Fusion gegen Kristallisation
Eine chemische Reaktion tritt durch Absorption oder entwickelnde Energie in Form von Wärme auf. Die Wärme von Fusion und Kristallisation sind zwei Beispiele für diese Art von Reaktionen. Der Hauptunterschied zwischen Fusionswärme und Kristallisation besteht darin, dass sich die Wärme der Fusion auf die Energieänderung bezieht Mol einer bestimmten Substanz erfährt Kristallisation.
Referenz:
1. "Schmelzwärme.”Chemistry Libretexten, Libretexte, 14. Juli 2020, hier verfügbar.
Bild mit freundlicher Genehmigung:
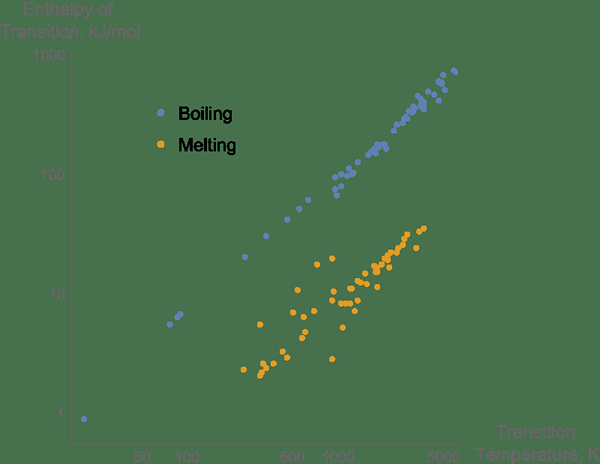
1. "Enthalpien des Schmelzens und Kochens für reine Elemente im Vergleich zu den Temperaturen des Übergangs" von Mgibby5 (CC BY-SA 3.0) über Commons Wikimedia
2. "SnowflakeswilsonBentley" von Wilson Bentley - Tafel XIX von "Studien unter den Schneekristallen ..." von Wilson Bentley, "The Snowflake Man".”Aus einer jährlichen Zusammenfassung der„ monatlichen Wetterüberprüfung “für 1902 (Public Domain) über Commons Wikimedia