Unterschied zwischen homolytischer und heterolytischer Spaltung
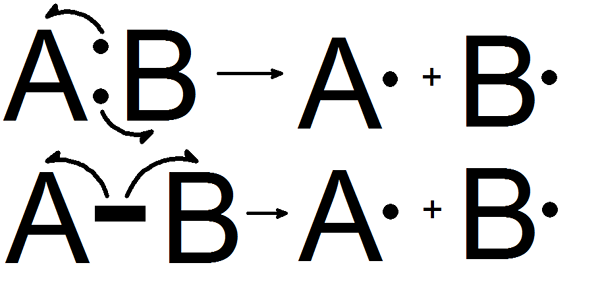
Der Schlüsselunterschied Zwischen homolytischer und heterolytischer Spaltung befindet sich die Die homolytische Spaltung verleiht jedem Fragment ein Bindungselektron, während die heterolytische Spaltung zwei Bindungselektronen für ein Fragment und keines der Bindungselektronen zu dem anderen Fragment verleiht.
Spaltung ist die Zerstörung einer kovalenten chemischen Bindung. Mit anderen Worten, es unterteilt ein Molekül in zwei Einheiten. Die Spaltung kommt in zwei Formen als homolytische Spaltung, die zwei gleiche Einheiten und eine heterolytische Spaltung bildet, die zwei ungleiche Einheiten bildet.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist homolytische Spaltung
3. Was ist heterolytische Spaltung
4. Seite an Seitenvergleich - homolytische vs heterolytische Spaltung in tabellarischer Form
5. Zusammenfassung
Was ist homolytische Spaltung?
Die homolytische Spaltung ist die Dissoziation einer chemischen Bindung und bildet zwei gleiche Fragmente. Eine chemische Bindung (kovalente Bindung) enthält zwei Elektronen. In dieser Form der Spaltung erhält jedes der Fragmente ein ungepaartes Elektron. Wenn diese Bindungsdissoziation in einem neutralen Molekül auftritt, das eine gleichmäßige Anzahl von Elektronen hat, bildet sie zwei gleiche, freie Radikale.
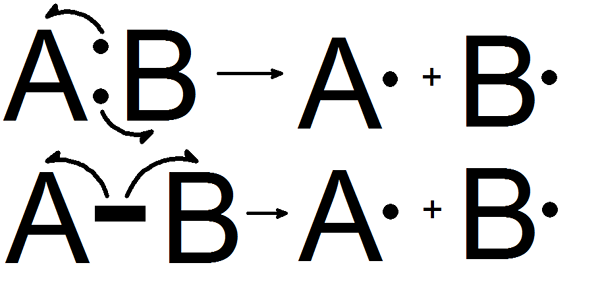
Abbildung 01: Homolytische Spaltung
Homolytische Bindungsdissoziationsenergie bezieht sich auf die Energie, die während dieses Prozesses entweder absorbiert oder freigesetzt wird. Diese Spaltung findet jedoch nur unter bestimmten Bedingungen statt
- UV-Strahlung
- Hitze
Darüber hinaus sind einige bestimmte chemische Bindungen wie Peroxidbindung schwach genug, um spontan bei einer leichten Wärme zu dissoziieren.
Was ist heterolytische Spaltung?
Die heterolytische Spaltung ist die Dissoziation einer chemischen Bindung und bildet zwei ungleiche Fragmente. Eine chemische Bindung (kovalente Bindung) enthält zwei Elektronen. In dieser Form der Spaltung erhält ein Fragment beide Bindungselektronenpaare, während andere Fragment keine der Bindungselektronen erhält.
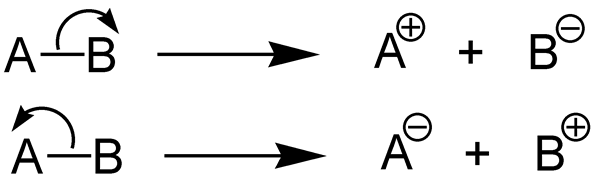
Abbildung 02: heterolytische Spaltung
Das Fragment, das beide Bindungselektronen bekommt, bilden einen Anion. Das andere Fragment bildet ein Kation. Dort ist das Fragment, das beide Elektronen erhält, elektronegativer als das andere Fragment. Diese Spaltung tritt in einzelnen kovalenten Bindungen auf. Die Energie, die während dieser Bindungsspaltung entweder absorbiert oder freigesetzt wird, wird als "heterolytische Bindungsdissoziationsenergie" bezeichnet.
Was ist der Unterschied zwischen homolytischer und heterolytischer Spaltung?
Die homolytische Spaltung ist die Dissoziation einer chemischen Bindung und bildet zwei gleiche Fragmente. Es gibt ein Bindungselektron für jedes Fragment. Die Energie, die während der homolytischen Spaltung entweder absorbiert oder freigesetzt wird, wird als „homolytische Bindungsdissoziationsenergie“ bezeichnet. Die heterolytische Spaltung ist die Dissoziation einer chemischen Bindung und bildet zwei ungleiche Fragmente. Es gibt zwei Bindungselektronen zu einem Fragment und keinem der Bindungselektronen zu dem anderen Fragment. Dies ist der Schlüsselunterschied zwischen homolytischer und heterolytischer Spaltung. Die Energie, die während der heterolytischen Spaltung entweder absorbiert oder freigesetzt wird, wird als „heterolytische Bindungs -Dissoziationsenergie“ bezeichnet.
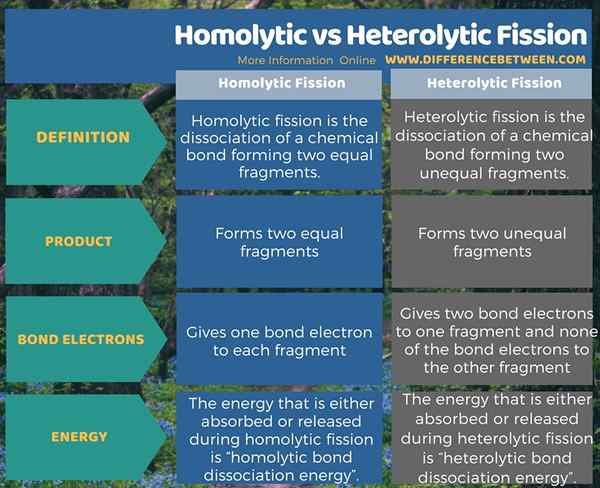
Zusammenfassung -homolytische gegen heterolytische Spaltung
Spaltung ist die Dissoziation der Anleihe. Es ist in zwei Formen als homolytische und heterolytische Spaltung. Der Unterschied zwischen homolytischer und heterolytischer Spaltung besteht darin, dass die homolytische Spaltung jedes Fragment ein Bindungselektron verleih.
Referenz:
1. „Homolyse (Chemie).Wikipedia, Wikimedia Foundation, 17. Juli 2018. Hier verfügbar
2. „Enzymaktivator.Wikipedia, Wikimedia Foundation, 15. Juli 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Pfeil homolytisch von Shoy - eigene Arbeit, (öffentlich zugänglich) über Commons Wikimedia
2.'Heterolyse (Chemie)' von Jürgen Martens - Jürgen Martens, (CC BY -SA 3.0) über Commons Wikimedia


