Unterschied zwischen hypervalenten und hypovalenten Verbindungen
Der Schlüsselunterschied Zwischen hypervalenten und hypovalenten Verbindungen befindet sich das Hypervalente Verbindungen enthalten ein zentrales Atom mit mehr als acht Elektronen in der Valenzelektronenhülle, während hypovalente Verbindungen ein zentrales Atom mit weniger als acht Elektronen in der Valenzelektronenhülle enthalten.
Die Begriffe hypervalent und hypovalent beziehen sich auf anorganische kovalente Verbindungen, die ein zentrales Atom enthalten. Diese beiden Arten von Verbindungen unterscheiden sich je nach Anzahl der Elektronen im zentralen Atom - hypervalente Verbindungen haben ein vollständig.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind hypervalente Verbindungen
3. Was sind hypovalente Verbindungen
4. Seite an Seitenvergleich - hypervalent gegen hypovalente Verbindungen in tabellarischer Form
5. Zusammenfassung
Was sind hypervalente Verbindungen?
Hypervalente Verbindungen sind chemische Spezies, die ein zentrales Atom mit mehr als acht Elektronen in der Valenzelektronenhülle enthalten. Wir nennen es auch ein erweitertes Oktett. Der erste Wissenschaftler, der diese Art von Molekülen definiert hat, ist Jeremy I. Musher, 1969. Es gibt mehrere Klassen von hypervalenten Verbindungen wie hypervalente Jodverbindungen, Edelgasverbindungen wie Xenonverbindungen, Halogen -Polyfluoride usw.
Abbildung 01: Hypervalente Verbindungen
Die chemische Bindung in hypervalenten Verbindungen kann basierend auf der molekularen Orbitalentheorie beschrieben werden. Wenn wir beispielsweise die Schwefelhexafluoridverbindung einnehmen. Daher gibt es 12 Elektronen um das Schwefelatom. Nach der molekularen Orbitalentheorie tragen das 3S -Orbital, drei 3p -Orbitale und sechs 2p -Orbitale aus jedem Fluoratom zur Bildung dieser Verbindung bei. Daher sind insgesamt zehn Atomorbitale an der Zusammensetzung der Zusammensetzung beteiligt. Nach den Elektronenkonfigurationen von Schwefel und Fluor ist Platz für 12 Valenzelektronen. Da es 12 Elektronen gibt, ist die Schwefelhexafluoridverbindung eine hypervalente Verbindung.
Was sind hypovalente Verbindungen?
Hypovalente Verbindungen sind chemische Spezies, die ein zentrales Atom mit weniger als acht Elektronen in der Valenzelektronenhülle enthalten. Daher werden diese als elektronenmangelige Spezies bezeichnet. Im Gegensatz zu hypervalenten Verbindungen sind fast alle hypovalenten Verbindungen nichtionische Spezies. Daher sind sie größtenteils angetrieben oder körnige Verbindungen.

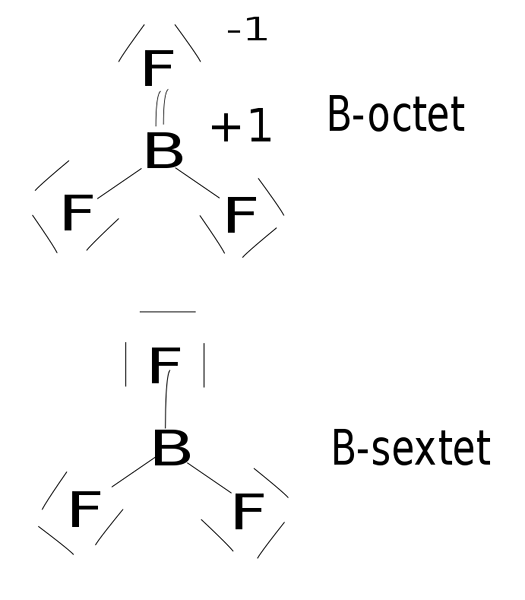
Abbildung 02: Bor Trifluorid ist eine hypovalente Verbindung
Diese kovalenten Verbindungen tragen nicht mehr als vier einzelne kovalente Bindungen um sie herum, da sich vier kovalente Verbindungen auf acht Elektronen beziehen. Darüber hinaus sind die Formen der kovalenten Verbindungen größtenteils linear oder trigonal planar.
Was ist der Unterschied zwischen hypervalenten und hypovalenten Verbindungen?
Der Schlüsselunterschied zwischen hypervalenten und hypovalenten Verbindungen besteht darin, dass hypervalente Verbindungen chemische Spezies sind. Darüber hinaus sind die meisten hypervalenten Verbindungen ionische Spezies, während fast alle hypovalenten Verbindungen kovalente Verbindungen sind.
Darüber hinaus sind die Formen kovalenter hypervalenter Verbindungen entweder tetragonale oder komplexere Strukturen, während hypovalente Verbindungen keine komplizierten Strukturen bilden können; Sie sind entweder linear oder trigonal planar. Dies ist daher auch ein signifikanter Unterschied zwischen hypervalenten und hypovalenten Verbindungen. Außerdem gibt es mehr als vier kovalente Bindungen um das zentrale Atom hypervalenter Verbindungen, aber es gibt zwei oder drei kovalente Bindungen um das zentrale Atom hypovalenter Verbindungen.

Zusammenfassung -Hypervalent gegen hypovalente Verbindungen
Die Begriffe hypervalent und hypovalent beschreiben anorganische kovalente Verbindungen, die ein zentrales Atom enthalten. Der Schlüsselunterschied zwischen hypervalenten und hypovalenten Verbindungen besteht darin, dass hypervalente Verbindungen chemische Spezies sind, die ein zentrales Atom mit mehr als acht Elektronen in der Valenzelektronenhülle enthalten, aber hypovalente Verbindungen sind chemische Spezies, die ein zentrales Atom mit weniger als acht Elektronen in der Valenzelektronschale enthalten.
Referenz:
1. „Hypervalentes Molekül.” Wikipedia, Wikimedia Foundation, 18. Januar. 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Hypervalency Gamma -Berechnungen" von Marcus Durrant - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "BF3-Lewis" von JCWF bei Dutch Wikibooks (CC BY-SA 2.5) über Commons Wikimedia


