Unterschied zwischen ionischer Bindung und metallischer Bindung
Der Schlüsselunterschied zwischen ionischer Bindung und metallischer Bindung ist, dass die Ionenbindung findet zwischen positiven und negativen Ionen statt, während die metallische Bindung zwischen positiven Ionen und Elektronen stattfindet.
Als amerikanischer Chemiker G.N.Lewis schlug vor, Atome sind stabil, wenn sie acht Elektronen in ihrer Valenzschale enthalten. Die meisten Atome haben weniger als acht Elektronen in ihren Valenzschalen (mit Ausnahme der edlen Gase in Gruppe 18 des Periodenzüchtertabels); Daher sind sie nicht stabil. Diese Atome reagieren dazu, miteinander zu reagieren, um stabil zu werden. Somit kann jedes Atom eine edle -gas elektronische Konfiguration erreichen. Dies geschieht durch Bildung von Ionenbindungen, kovalenten Bindungen oder metallischen Bindungen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ionenbindung
3. Was ist metallische Bindung
4. Seite an Seitenvergleich - Ionenbindung gegen metallische Bindung in tabellarischer Form
5. Zusammenfassung
Was ist Ionenbindung?
Atome können Elektronen gewinnen oder verlieren und negative bzw. positive geladene Partikel bilden. Diese Partikel sind „Ionen“. Es gibt elektrostatische Wechselwirkungen zwischen diesen Ionen. Dementsprechend ist die Ionenverklebung die Anziehungskraft zwischen diesen entgegengesetzt geladenen Ionen.
Die Elektronegativität der Atome in einer ionischen Bindung beeinflusst die Stärke der elektrostatischen Wechselwirkungen. Daher ergibt die Elektronegativität eine Messung der Affinität der Atome zu Elektronen. Ein Atom mit hoher Elektronegativität kann Elektronen aus einem Atom mit geringer Elektronegativität anziehen, um eine ionische Bindung zu bilden.
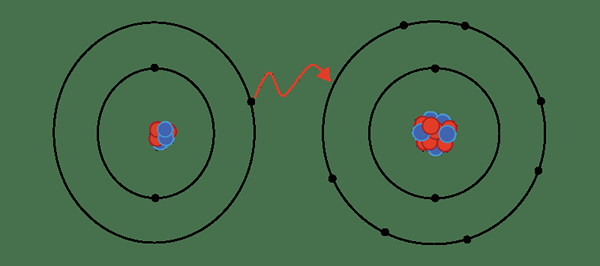
Abbildung 01: Ionische Bindung
Zum Beispiel hat Natriumchlorid eine ionische Bindung zwischen Natriumion und Chloridion. Natrium ist ein Metall; Daher hat es eine sehr niedrige Elektronegativität (0.9) im Vergleich zu Chlor (3.0). Aufgrund dieses Elektronegativitätsunterschieds kann Chlor ein Elektron aus Natrium anziehen und CL bilden- und na+ Ionen. Aus diesem Grund gewinnen beide Atome die stabile, edel -gas elektronische Konfiguration. Cl- und na+ werden durch attraktive elektrostatische Kräfte zusammengehalten und so eine ionische Bindung bilden.
Was ist metallische Bindung?
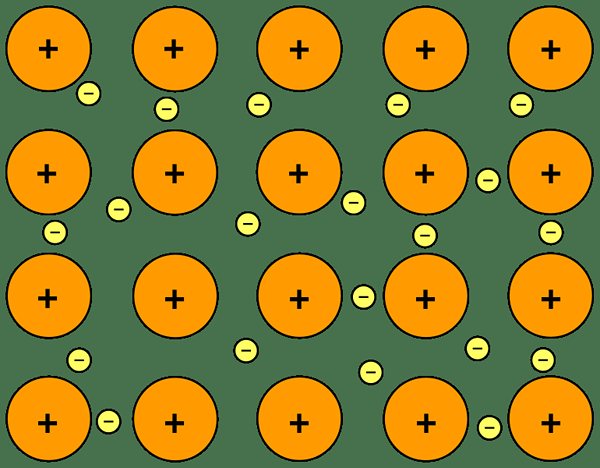
Metalle sind Atome, die Kationen bilden können, indem sie Elektronen entfernen. Gruppe 1, Gruppe 2 und Übergangselemente sind Metalle. Die meiste Zeit befinden sich Metalle in der festen Phase. Die Art der Bindungsformen zwischen Metallatomen ist „metallische Bindung“.
Metalle füllen Elektronen in ihren äußeren Schalen frei und diese Elektronen dispergieren zwischen Metallkationen. Deshalb nennen wir es ein „Meer delokalisierter Elektronen“. Die elektrostatischen Wechselwirkungen zwischen den Elektronen und Kationen werden als metallische Bindung bezeichnet.

Abbildung 02: Metallische Bindung
Die Anzahl der Elektronen, die die Metallatome in das Meer freisetzen, und die Größe des Kationen bestimmt die Stärke der metallischen Bindung. Die Größe der Kationen ist umgekehrt proportional zur Stärke der Bindung und auch der Anzahl der Elektronen, die ein Metallatom veröffentlicht.
Darüber hinaus können sich die Elektronen bewegen; Metalle haben daher die Fähigkeit, Elektrizität zu leiten. Wegen der metallischen Bindungsmetalle haben eine geordnete Struktur. Hohe Schmelzpunkte und Siedepunkte von Metallen sind auch auf diese starke metallische Bindung zurückzuführen. Metalle sind aus dem gleichen Grund stark und nicht spröde.
Was ist der Unterschied zwischen ionischer Bindung und metallischer Bindung?
Die ionische Bindung ist eine Art chemischer Bindung, die zwischen zwei entgegengesetzt geladenen Ionen auftritt, während die metallische Bindung die Art der chemischen Bindung ist, die in einem Metallgitter auftritt. Daher besteht der Hauptunterschied zwischen ionischer Bindung und metallischer Bindung darin, dass die ionische Bindung zwischen positiven und negativen Ionen stattfindet, während die metallische Bindung zwischen positiven Ionen und Elektronen stattfindet.
Als ein weiterer wichtiger Unterschied zwischen ionischer Bindung und metallischer Bindung können wir den Einfluss der Elektronegativität von Atomen auf die Bindungsstärke berücksichtigen. Das ist; Die Elektronegativität hat keinen Einfluss auf die metallische Bindung, da die gleiche Art von Atomen an der Bindung beteiligt ist, aber die Stärke der Bindung wird stark durch den Elektronegativitätsunterschied zwischen positiven und negativen Ionen bei der ionischen Bindung beeinflusst. Darüber hinaus ist die ionische Bindung viel stärker als die metallische Bindung.
Die folgende Infografik zum Unterschied zwischen ionischer Bindung und metallischer Bindung zeigt mehr Unterschiede zwischen beiden Bindungen.
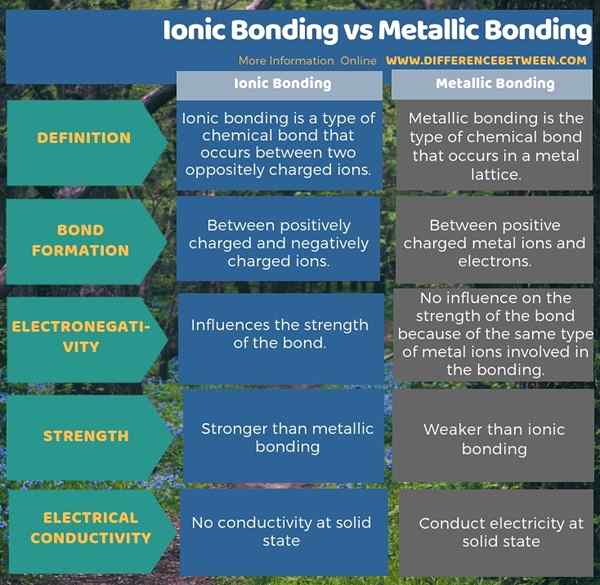
Zusammenfassung -Ionische Bindung gegen metallische Bindung
Es gibt drei Haupttypen der chemischen Bindung. Sie sind die ionische Bindung, die kovalente Bindung und die metallische Bindung. Der Hauptunterschied zwischen ionischer Bindung und metallischer Bindung besteht darin, dass die ionische Bindung zwischen positiven und negativen Ionen stattfindet, während die metallische Bindung zwischen positiven Ionen und Elektronen stattfindet.
Referenz:
1. Libretexten. „Ionische und kovalente Bindungen.”Chemistry Libretexten, National Science Foundation, 28. Februar. 2018. Hier verfügbar
2. Libretexten. "Metallische Bindung.”Chemistry Libretexten, National Science Foundation, 31. Juli 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Ionische Bindung" von Eliseetc - eigene Arbeit (CC BY -SA 3).0) über Commons Wikimedia
2."Metallic Bindung" von Muskid - eigene Arbeit (CC BY -SA 3).0) über Commons Wikimedia


