Unterschied zwischen empirischen und molekularen Formeln
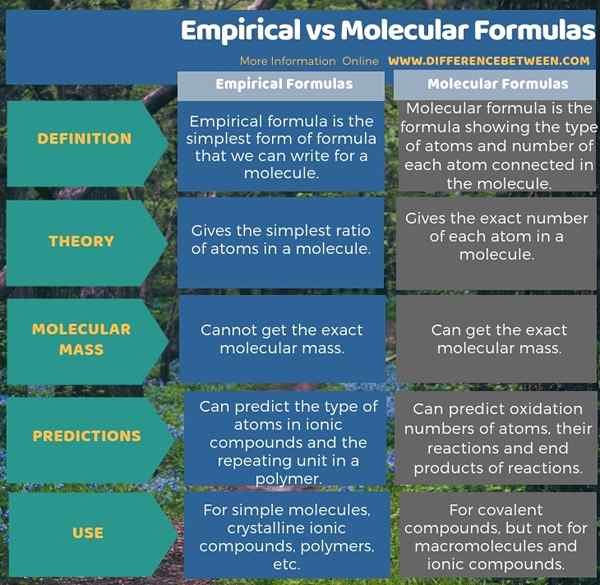
Der Schlüsselunterschied zwischen empirischen und molekularen Formeln sind das eine Die empirische Formel ergibt nur das einfachste Verhältnis von Atomen, während eine molekulare Formel die genaue Anzahl jedes Atoms in einem Molekül ergibt.
In der Chemie verwenden wir häufig Symbole, um Elemente und Moleküle zu identifizieren. Molekulare Formel und empirische Formel sind zwei solcher symbolischen Methoden, mit denen wir Moleküle und Verbindungen auf einfache Weise darstellen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind empirische Formeln
3. Was sind molekulare Formeln
4. Seite an Seitenvergleich - empirische vs Molekülformeln in tabellarischer Form
5. Zusammenfassung
Was sind empirische Formeln?
Empirische Formeln sind die einfachste Form von Formeln, die wir für ein Molekül schreiben können. Es zeigt die Art der Atome im Molekül, aber es gibt nicht die reale Anzahl jedes Atoms. Es gibt vielmehr das einfachste Ganzzahlverhältnis jedes Atoms des Moleküls.
Zum Beispiel c6H12Ö6 ist die molekulare Formel von Glukose und CH2O ist seine empirische Formel. Meistens geben wir empirische Formeln für ionische Verbindungen an, die sich in der kristallinen Form befinden. Zum Beispiel können wir die genaue Anzahl von Na und CL in einem NaCl -Kristall nicht sagen. Also schreiben wir einfach die empirische Formel, die das Verhältnis von verbundenen Atomen bezeichnet.
Video 01: Empirische Formel
Weiter, ca3(Po4)2 ist auch eine empirische Formel. In einer ionischen Verbindung können wir die Formel leicht schreiben, indem wir die Ladungen jedes Ions austauschen, und das gibt die Zahl von jedem Ion im Molekül automatisch an. Außerdem können wir empirische Formeln für Makromoleküle schreiben. Beim Schreiben empirischer Formeln für Polymere schreiben wir die sich wiederholende Einheit und verwenden dann den Buchstaben „N“, um zu sagen, dass es eine Anzahl von Wiederholungseinheiten im Polymer geben kann. Wir können jedoch nicht die empirische Formel verwenden, um die Masse, Struktur oder Isomere eines Moleküls zu finden, ist jedoch für analytische Zwecke nützlich.
Was sind molekulare Formeln?
Molekulare Formeln sind die Formeln, die die Art der Atome und die Anzahl jedes im Molekül verbundenen Atoms zeigen. Daher gibt es die richtige Stöchiometrie jedes Atoms. Die Atome werden durch ihre Symbole dargestellt. Darüber hinaus sollten wir die Anzahl der Atome als Indexs schreiben. Einige molekulare Formeln sind neutral (keine Ladung), aber wenn es eine Ladung gibt, können wir sie auf der rechten Seite als Superscript zeigen.
Normalerweise verwenden wir die molekulare Formel in den chemischen Reaktionen oder bei der Dokumentation chemischer Details. Wenn wir uns nur die molekulare Formel ansehen, können wir viele Informationen über das Molekül erhalten. Zum Beispiel können wir die molekulare Masse berechnen. Wenn es sich um eine ionische Verbindung handelt, können wir vorhersagen, was die Ionen sind und wie viele von ihnen freigesetzt werden, wenn sie in Wasser gelöst sind.
Video 02: Vergleich von molekularen und empirischen Formeln
Darüber hinaus können wir die Oxidationszahlen jedes Atoms vorhersagen, wie sie in einer Reaktion reagieren werden, und die entstandenen Produkte unter Verwendung molekularer Formeln. Wir können jedoch nur aus der molekularen Formel die genaue molekulare Anordnung nicht vorhersagen. Weil es manchmal mehrere Strukturformeln für eine einzelne molekulare Formel gibt. Dies sind die "Isomere". Isomere haben die gleiche molekulare Formel, können sich jedoch von der Konnektivität von Atomen (konstitutionellen Isomeren) oder der räumlichen Anordnung von Atomen (Stereoisomeren) unterscheiden. Wenn wir also die molekulare Formel betrachten, können wir alle möglichen Isomere für ein Molekül schreiben.
Was ist der Unterschied zwischen empirischen und molekularen Formeln?
Empirische Formeln sind die einfachste Form von Formeln, die wir für ein Molekül schreiben können, während molekulare Formeln die Formeln sind, die die Art der Atome und die Anzahl der im Molekül verbundenen Atom zeigen. Daher besteht der Schlüsselunterschied zwischen empirischen und molekularen Formeln darin, dass die empirische Formel nur das einfachste Verhältnis von Atom ergibt, während die molekulare Formel die genaue Anzahl jedes Atoms in einem Molekül ergibt. Darüber hinaus können wir die genaue molekulare Masse unter Verwendung der empirischen Formel nicht berechnen, während wir die genaue Molekülmasse unter Verwendung der molekularen Formel erhalten können.
Als ein weiterer wichtiger Unterschied zwischen empirischen und molekularen Formeln können wir sagen, dass wir die Art der Atome in ionischen Verbindungen und die Wiederholungseinheit in einem Polymer vorhersagen können, während wir die Oxidationszahlen jedes Atoms vorhersagen können, wie sie in einer Reaktion reagieren werden und die entstandenen Produkte unter Verwendung molekularer Formeln.

Zusammenfassung -empirische gegen molekulare Formeln
Für ein bestimmtes Molekül oder ein Makromolekül können wir eine empirische Formel schreiben. Die molekulare Formel ist jedoch die detailliertere Form. Der Schlüsselunterschied zwischen empirischen und molekularen Formeln besteht darin, dass eine empirische Formel nur das einfachste Verhältnis von Atom ergibt, während eine molekulare Formel die genaue Anzahl jedes Atoms in einem Molekül ergibt.
Referenz:
1. „Empirische Formel 2." Übergangsmetalle. Hier verfügbar
2. Libretexten. “6.9: Berechnung der molekularen Formeln für Verbindungen.”Chemistry Libretexten, National Science Foundation, 20. Mai 2018. Hier verfügbar
Video mit freundlicher Genehmigung:
1.”75649220" von Elearn.Punjab über Vimeo
2.”34647886“ von Dick Trent über Vimeo


