Unterschied zwischen Ionisation und Dissoziation
Schlüsselunterschied - Ionisation gegen Dissoziation
Ionisierung und Dissoziation sind zwei wichtige Prozesse in der Chemie. Ionisation und Dissoziation werden oft verwirrt, insbesondere bei der Auflösung von ionischen Verbindungen. Man könnte denken, dass das Auflösen ionischer Verbindungen zu einer Ionisierung führt, da sich ionische Verbindungen in Wasser auflösen und geladene Partikel oder Ionen erzeugen. Dies ist jedoch eine Instanz der Dissoziation, da bereits ionische Verbindungen aus Ionen hergestellt werden. Daher ist der Schlüsselunterschied zwischen Ionisation und Dissoziation das Ionisierung ist die Produktion neuer Ionen durch Gewinn oder Elektronenverlust wohingegen Dissoziation ist die Spaltung oder Trennung von Ionen, die bereits in einer Verbindung existieren.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Ionisation
3. Was ist Dissoziation
4. Seite an Seitenvergleich - Ionisation gegen Dissoziation
5. Zusammenfassung
Was ist Ionisation?
Ionisierung ist der Prozess, der ein geladenes Atom oder ein Molekül durch Gewinn oder Verlust eines Elektrons erzeugt. Dieser Prozess erzeugt ein geladenes Teilchen. In diesem Prozess werden elektrisch neutrale Atome zu elektrisch geladenen Partikeln. Diese Ladung kann entweder positiv oder negativ sein. Das hängt vom Gewinn oder Verlust eines Elektrons ab. Wenn ein Atom oder ein Molekül ein Elektron verliert, wird es positiv aufgeladen, während es, wenn es von außen ein Elektron erhält, negativ aufgeladen wird. Der Ionisationsprozess ist normalerweise irreversibel, was bedeutet, dass ein Atom oder ein Molekül ein Elektronen erhält, es wird dieses Elektronenrücken nicht freigesetzt. Wenn ein Atom ein Elektron verliert, nimmt es kein Elektron zurück. Dies geschieht, wenn der Verlust oder der Gewinn dieses Elektrons ein stabiles Ion verursacht, das der Oktettregel folgt.
Manchmal wird der Begriff Ionisation mit Dissoziation verwechselt. Wenn eine ionische Verbindung wie Natriumchlorid (NaCl) berücksichtigt wird, bildet sie Ionen, wenn sie in Wasser gelöst ist. Obwohl dies Ionen bildet, ist dies keine Ionisierung. Da der feste NaCl in seine Ionen aufgeteilt ist oder ihre ionischen Bindungen gebrochen sind, kann sie nicht als Ionisation bezeichnet werden. Daher ist die Aufteilung einer ionischen Bindung kein Ionisationsprozess, da ein Elektron bereits ein Atom durch das andere Atom gegeben hat und nur eine elektrostatische Anziehung vorhanden ist. Daher kann gesagt werden, dass Verbindungen mit ionischen Bindungen nicht an der Ionisierung teilnehmen werden. Obwohl ionische Verbindungen keine Ionisierung durchlaufen können, können kovalente Verbindungen mit kovalenten Bindungen zwischen Atomen eine Ionisierungsprozess durchlaufen. Dies liegt daran. Ionisation tritt jedoch nur in polaren kovalenten Verbindungen auf, die Atome mit einem erheblichen Unterschied in der Elektronegativität haben. Andernfalls tritt eine Ionisation aufgrund einer starken kovalenten Bindung nicht auf. Die Ionisierung findet auch in Metallen statt. Dort werden positiv geladene Metallionen erzeugt, indem Elektronen aus Metallatomen freigelassen werden.
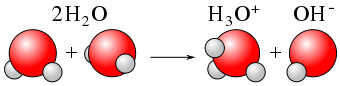
Abbildung 01: Ionisierung
Was ist Dissoziation?
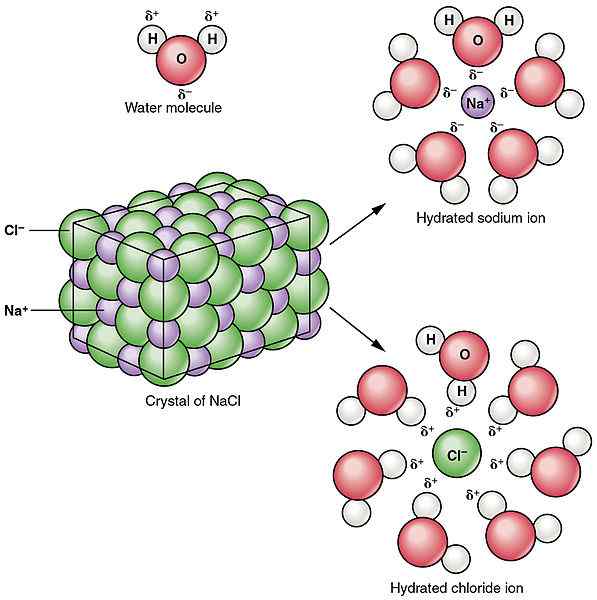
Die Dissoziation bezieht sich auf das Brechen oder die Spaltung einer Verbindung in kleinere Partikel. Dissoziationsprozess kann zu Produkten führen, die entweder elektrisch aufgeladen oder neutral sind. Dies beinhaltet nicht den Gewinn oder den Verlust von Elektronen durch die Atome. Im Gegensatz zum Ionisationsprozess ist die Dissoziation die Trennung von Ionen, die bereits in einer Verbindung existierten. Manchmal kann die Dissoziation auch neutrale Partikel produzieren. Zum Beispiel die Aufschlüsselung von n2Ö4 führt zur Produktion von zwei Molekülen von NO2. Dissoziationsprozesse sind die meiste Zeit reversibel. Dies bedeutet, dass getrennte Ionen neu arrangiert werden können, um die vorherige Verbindung herzustellen. Wie oben erwähnt, ist das Auflösen von NaCl beispielsweise ein Dissoziationsprozess und erzeugt zwei geladene Partikel. Solid NaCl kann jedoch erneut mit gegebenen ordnungsgemäßen Bedingungen erhalten werden, was beweist, dass die Dissoziation reversibel ist. Im Gegensatz zur Ionisation findet die Dissoziation in ionischen Verbindungen statt.

Abbildung 02: Dissoziation von Natriumchlorid in Wasser
Was ist der Unterschied zwischen Ionisation und Dissoziation?
Ionisation gegen Dissoziation | |
| Ionisierung ist der Prozess, der neue geladene Partikel erzeugt. | Dissoziation ist die Trennung geladener Partikel, die bereits in einer Verbindung existieren. |
| Anfangsverbindung | |
| Die Ionisation beinhaltet polare kovalente Verbindungen oder Metalle | Dissoziation beinhaltet ionische Verbindungen. |
| Produkt | |
| Die Ionisierung erzeugt immer geladene Partikel | Die Dissoziation erzeugt entweder geladene Partikel oder elektrisch neutrale Partikel. |
| Verfahren | |
| Ionisierungsprozess ist irreversibel. | Dissoziation ist reversibel. |
| Fesseln | |
| Die Ionisation beinhaltet kovalente Bindungen zwischen Atomen | Die Dissoziation beinhaltet Ionenbindungen in Verbindungen. |
Zusammenfassung -Ionisation gegen Dissoziation
Ionisierung und Dissoziation sind zwei verschiedene Prozesse. Daher ist es sehr wichtig, den Unterschied zwischen diesen beiden Prozessen zu verstehen. Der Schlüsselunterschied zwischen Ionisation und Dissoziation besteht darin, dass die Dissoziation der Prozess der Trennung von geladenen Partikeln ist, die bereits in der Verbindung existierten, während die Ionisierung die Bildung neuer geladener Partikel ist, die in der vorherigen Verbindung nicht vorhanden waren.
Verweise:
1. Hamza, s. A., 2014. Slide Share. [Online] Verfügbar unter: https: // www.Slideshare.Net/Sheikhamirhamza/DSSOCIATION-VS-IONISIZIONPPT [Zugriff auf 29 05 2017].
2. Chang, r., 2010. Chemie. 10. Aufl. New York: McGraw-Hill.
Bild mit freundlicher Genehmigung:
1. "214 Dissoziation von Natriumchlorid in Water -01" vom OpenStax College - Anatomy & Physiology, Connexions Website. 19. Juni 2013. (CC von 3.0) über Commons Wikimedia
2. "Autoprotolyse eau" von CDang - eigene Arbeit (Public Domain) über Commons Wikimedia


