Unterschied zwischen Oktett und Duplet
Schlüsselunterschied - Oktet gegen Duplet
In der Natur gibt es chemisch aktive und inaktive Atome oder Verbindungen. Diese Eigenschaft hängt hauptsächlich von der Anzahl der Elektronen ab, die in den äußersten Schalen der Atome vorhanden sind. Atome mit unvollständigen Schalen können aktiv werden, um ihre Elektronenkonfiguration zu vervollständigen, um stabil zu werden. Inaktive Atome haben eine vollständige Elektronenkonfiguration. Somit reagieren diese Atome nur mit einem anderen Atom, es sei denn unter besonderen Bedingungen. Edelgase sind immer inaktiv in der Natur. Daher sind sie als inerte Gase bekannt. Inerte Gase befinden sich in der achten Säule in der Periodenzüchttabelle. Andere Elemente im gleichen Zeitraum (ROW) neigen dazu, die Elektronenkonfiguration des Inertgas am Ende dieses Zeitraums zu erhalten, was die stabilste Form in der Natur ist. Aktive Atome neigen dazu, die Anzahl der Elektronen nach Abschluss der Elektronen zu vervollständigen Oktettregel oder Duplet -Regel. Der Schlüsselunterschied zwischen Oktett und Duplet ist das Oktett ist ein Atom oder ein Ion mit maximal acht Elektronen in der äußersten Hülle während Duplet ist ein Atom mit maximal zwei Elektronen in der äußersten Hülle.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein Oktett
3. Was ist ein Duplet
4. Nebenseitiger Vergleich - Oktet gegen Duplet
5. Zusammenfassung
Was ist ein Oktett?
Ein Oktett ist ein Atom oder ein Ion mit acht Elektronen in der äußersten Hülle dieses Atoms. Alle edlen Gase außer Helium haben acht Elektronen und sind in der Natur inert. Die Elektronenkonfiguration eines edlen Gases endet immer wie folgt.
ns2 np6
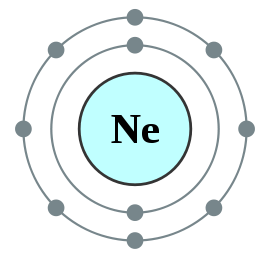
Zum Beispiel beträgt die Elektronenkonfiguration von Neon 1s22s22p6 . Neon ist ein inerter Gas.
Andere Elemente mit sieben, sechs usw. Elektronen im äußersten Orbital neigen dazu, die Oktettregel zu befolgen, indem sie Elektronen von außen erhalten; Einige andere Elemente mit einem, zwei usw. Elektronen tendenziell an Elektronen verlieren und die Elektronenkonfiguration des nächsten Inertgas erhalten. Andere Elemente in der Mitte des Periodenzüchtertabels bilden jedoch neue Bindungen mit Elementen mit überschüssigen Elektronen, um diese Elektronen zu teilen und ein Oktett zu werden.
Abbildung 01: Neon, ein Oktett
Was ist ein Duplet?
Wasserstoffatom und Heliumatom sind die kleinsten Elemente in der Natur und haben nur ein Orbital um ihren Kern. Dieses Orbital wird als 1S -Orbital bezeichnet. Dieses Orbital kann maximal zwei Elektronen enthalten. Wasserstoffatom hat ein Elektron und Helium hat zwei Elektronen. Daher wird Helium als Duplet bezeichnet. Helium hat die maximale Anzahl von Elektronen, die es haben kann; Somit ist es ein stabiles Element in der Natur. Daher ist Helium auch ein inerter Gas. Aber Wasserstoff hat nur ein Elektron und das einzige Orbital, das es hat, ist unvollständig. Daher ist Wasserstoffatom allein sehr reaktiv und bildet tendenziell eine kovalente Bindung mit einem anderen Wasserstoffatom, indem es die einzigen Elektronen, die sie haben. Dann werden diese Wasserstoffatome zu Duplets, da sie jetzt zwei Elektronen in ihren äußersten Orbitalen haben. Lithium kann sich aber auch als Duplet verhalten, indem das Elektron aus seinem äußersten Orbital entfernt wird. Die Elektronenkonfiguration von Lithium beträgt 1s22s1. Durch Entfernen der 2s1 Elektron, es kann ein Duplet werden. In diesem Fall, er, h- und li+ sind Duplets, die als stabile Duplets existieren können.
Alle Duplets haben die Elektronenkonfiguration wie folgt.
ns2

Abbildung 02: Helium, ein Duplet
Was ist der Unterschied zwischen Oktett und Duplet?
Oktett gegen Duplet | |
| Oktett hat acht Elektronen in der äußersten Hülle. | Duplet hat zwei Elektronen in der äußersten Hülle. |
| Gemeinsame Elektronenkonfiguration | |
| Oktett hat ns2 np6 Geben Sie die Elektronenkonfiguration am Ende ein. | Duplet hat ns2 Geben Sie die Konfiguration am Ende ein. |
| Anzahl der Orbitale | |
| Oktett kann mindestens zwei Orbitale haben. | Ein Duplet hat nur ein Orbital. |
| Art der Orbitale | |
| Ein Oktett kann alle Arten von Orbitalen wie S, P, D, F usw. haben. | Duplet hat nur S -Orbital. |
Zusammenfassung - Oktet gegen Duplet
Alle Elemente neigen dazu, stabil zu werden. Bei unvollständigen Elektronenkonfigurationen können Atome jedoch nicht stabil sein. So werden sie sehr reaktiv, um die Schalen mit Elektronen zu füllen, indem sie Elektronen gewinnen, verlieren oder teilen. Die Atome oder Moleküle, die der Oktett- oder Duplet -Regel gehorchen, sind stabil. Der wichtigste Unterschied zwischen Oktett und Duplet besteht darin.
Verweise:
1. Nema, p., 2011. TOPPERLEARNING. [Online] Verfügbar unter: http: // www.TOPPERLEARNING.COM/FORUMS/Home-Work-HELP-19/What-is-Octet-Duplet-Valency-and-Ine-Chemistry-Struktur-of-the-ATOM-46317/Antwort [Zugriff auf 29 05 2017].
2.Chang, r., 2010. Chemie. 10. Aufl. New York: McGraw-Hill.
3.Anon., 2015. Stapler. [Online] verfügbar unter: http: // crodr.COM/NTSE-COPPETE-COURSE/CHEMICAL-BONDING/CHEMICAL-ACTIVITY OF-AN/19176-3853-37737-STUDY-WTW [Zugriff auf 29 05 2017].
Bild mit freundlicher Genehmigung:
1. "Elektronenschale 002 Helium - No Etikett" von Pumbaa (Originalarbeit von Greg Robson) - Elektronenschalendiagramme (entsprechende markierte Version) (CC BY -SA 2.0 uk) über Commons Wikimedia
2. "Electron Shell 010 Neon" von Pumbaa (Originalarbeit von Greg Robson) (CC BY-SA 2.0 uk) über Commons Wikimedia


