Unterschied zwischen Isomeren und Resonanz

Isomere gegen Resonanz | Resonanzstrukturen gegen Isomere | Konstitutionelle Isomere, Stereoisomere, Enantiomere, Diastereomere
Ein Molekül oder ein Ion mit derselben molekularen Formel kann auf unterschiedliche Weise existieren, abhängig von den Bindungsaufträgen, Ladungsverteilungsunterschieden, der Art und Weise, wie sie sich im Raum usw. anordnen usw.
Isomere
Isomere sind unterschiedliche Verbindungen mit der gleichen molekularen Formel. Es gibt verschiedene Arten von Isomeren. Isomere können hauptsächlich in zwei Gruppen als konstitutionelle Isomere und Stereoisomere unterteilt werden. Konstitutionelle Isomere sind Isomere, bei denen sich die Konnektivität von Atomen in Molekülen unterscheidet. Butan ist der einfachste Alkane, der konstitutionelle Isomerismus zeigt. Butan hat zwei konstitutionelle Isomere, Butan selbst und Isobuten.
CH3CH2CH2CH3 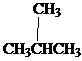
Butan-Isobutan/ 2-Methylpropan
In Stereoisomeren sind Atome in derselben Sequenz verbunden, im Gegensatz zu konstitutionellen Isomeren. Stereoisomere unterscheiden sich nur in der Anordnung ihrer Atome im Weltraum. Stereoisomere können zwei Arten, Enantiomere und Diastereomere sein. Diastereomere sind Stereoisomere, deren Moleküle keine Spiegelbilder voneinander sind. Die CIS-Trans-Isomere von 1, 2-Dichlorethen sind Diastereomere. Enantiomere sind Stereoisomere, deren Moleküle nicht superpositionsfähige Spiegelbilder voneinander sind. Enantiomere treten nur mit chiralen Molekülen auf. Ein chirales Molekül ist definiert als eines, das nicht mit seinem Spiegelbild identisch ist. Daher sind das chirale Molekül und sein Spiegelbild Enantiomere voneinander. Zum Beispiel ist 2-Butanol-Molekül chiral, und es und seine Spiegelbilder sind Enantiomere.
Resonanz
Beim Schreiben von Lewis -Strukturen zeigen wir nur Valenzelektronen. Durch die Teilen oder Übertragung von Elektronen versuchen wir, jedem Atom die edle gas elektronische Konfiguration zu geben. Bei diesem Versuch können wir den Elektronen jedoch einen künstlichen Ort auferlegen. Infolgedessen können mehr als ein äquivalente Lewis -Strukturen für viele Moleküle und Ionen geschrieben werden. Die Strukturen, die durch Ändern der Position der Elektronen geschrieben wurden, werden als Resonanzstrukturen bezeichnet. Dies sind Strukturen, die nur theoretisch existieren. Die Resonanzstruktur gibt zwei Tatsachen über die Resonanzstrukturen an.
- Keine der Resonanzstrukturen ist die korrekte Darstellung des tatsächlichen Moleküls; Keiner wird den chemischen und physikalischen Eigenschaften des tatsächlichen Moleküls völlig ähneln.
- Das tatsächliche Molekül oder das Ion wird am besten durch eine Mischung aller Resonanzstrukturen dargestellt.
Die Resonanzstrukturen werden mit dem Pfeil gezeigt ↔. Im Folgenden finden Sie die Resonanzstrukturen von Carbonation (CO)32-).
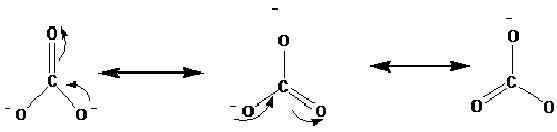
Röntgenstudien haben gezeigt, dass sich das tatsächliche Molekül zwischen diesen Resonanzen befindet. Nach den Studien sind alle Kohlenstoffoxygenbindungen im Carbonation in gleicher Länge liegen. Nach den oben genannten Strukturen können wir jedoch sehen, dass eine eine Doppelbindung ist, und zwei sind einzelne Bindungen. Wenn diese Resonanzstrukturen getrennt auftreten, sollte es im Idealfall unterschiedliche Bindungslängen im Ion geben. Die gleichen Bindungslängen zeigen, dass keine dieser Strukturen tatsächlich in der Natur vorhanden ist, sondern ein Hybrid davon existiert.
| Was ist der Unterschied zwischen Isomere und Resonanz? • In Isomeren können die Atomanordnung oder die räumliche Anordnung des Moleküls unterschiedlich sein. In Resonanzstrukturen ändern sich diese Faktoren jedoch nicht. Vielmehr haben sie nur eine Position der Position eines Elektrons. • Isomere sind natürlich vorhanden, aber in der Realität gibt es keine Resonanzstrukturen. Sie sind hypothetische Strukturen, die nur auf Theorie beschränkt sind. |


