Unterschied zwischen Isomorphismus und Polymorphismus
Schlüsselunterschied - Isomorphismus vs Polymorphismus
Verbindungen können in verschiedenen Formen in der Natur existieren. Diese verschiedenen Formen können unterschiedliche Morphologien oder unterschiedliche Strukturen sein. Die Struktur einer chemischen Verbindung bestimmt die physikalischen Eigenschaften dieser Verbindung. Manchmal werden die chemischen Eigenschaften auch durch die Struktur bestimmt. "Morphismus" ist ein Begriff, der verwendet wird, um den Begriff "Morphologie" zu benennen. Es beschreibt das äußere Erscheinungsbild einer Verbindung. Die Begriffe Isomorphismus und Polymorphismus werden verwendet, um diese externen Erscheinungen zu beschreiben. Polymorphismus bedeutet die Existenz einer Verbindung in mehr als einer kristallinen Form. Isomorphismus ist die Existenz von zwei oder mehr Verbindungen mit der gleichen Morphologie. Der Schlüsselunterschied Zwischen Isomorphismus und Polymorphismus ist das Der Isomorphismus bezieht sich auf das Vorhandensein von zwei oder mehr Verbindungen mit identischen Morphologien, während sich Polymorphismus auf das Vorhandensein verschiedener Morphologien derselben Substanz bezieht.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Isomorphismus
3. Was ist Polymorphismus
4. Seite an Seitenvergleich - Isomorphismus gegen Polymorphismus in tabellarischer Form
5. Zusammenfassung
Was ist Isomorphismus?
Der Isomorphismus bezieht sich auf das Vorhandensein von zwei oder mehr Verbindungen mit identischen Morphologien. Dies bedeutet die Existenz derselben Kristallstruktur in verschiedenen Verbindungen. Diese Verbindungen sind als isomorphe Substanzen bekannt. Isomorphe Substanzen haben nahezu die gleiche Form und Struktur.
Diese Verbindungen haben das gleiche Verhältnis zwischen den in diesen Verbindungen vorhandenen Atomen. Dies zeigt an, dass die empirischen Formeln isomorpher Substanzen identisch sind. Aber die physikalischen Eigenschaften der isomorphen Substanzen unterscheiden sich voneinander, weil sie unterschiedliche Atomkombinationen haben. EX: Masse, Dichte, chemische Reaktivität sind einige der physikalischen Eigenschaften, die sich in isomorphen Substanzen unterscheiden. Betrachten wir einige Beispiele, um zu verstehen, was Isomorphismus in der Chemie ist.
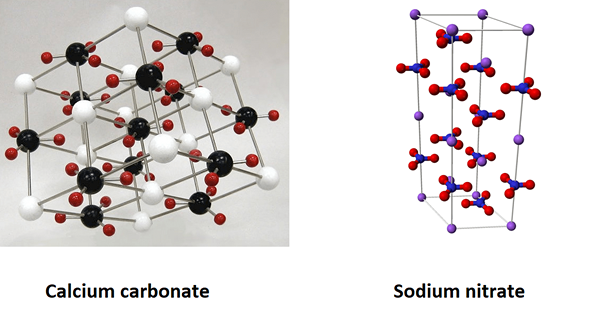
- Calciumcarbonat (Caco3) und Natriumnitrat (Nano3).

Abbildung 01: Der Vergleich von Calciumcarbonat und Natriumnitrat als isomorphe Substanzen
Sowohl Calciumcarbonat als auch Natriumnitrat haben eine trigonale Form. Das Atomverhältnis der in jeder Verbindung vorhandenen Atome beträgt 1: 1: 3. Diese Verbindungen haben jedoch unterschiedliche physikalische und chemische Eigenschaften. Ihre Molmassen unterscheiden sich auch voneinander (Calciumcarbonat = 100 g/mol und Natriumnitrat = 85 g/mol).
- Natriumphosphat (Na3Po4) und Natriumarsenat (Na3ASO4).
Diese Verbindungen existieren in tetraedrischer Form, und die empirische Formel dieser Verbindungen hat das Atomverhältnis 3: 1: 4. Aber sie haben unterschiedliche chemische und physikalische Eigenschaften.
Was ist Polymorphismus?
Polymorphismus bezieht sich auf das Vorhandensein verschiedener Morphologien derselben Substanz. Die Substanz, die Polymorphismus zeigt polymorphe Substanzen. Hier existiert eine bestimmte Verbindung in verschiedenen Formen und kristallinen Formen.
Die polymorphe Substanz zeigt Ähnlichkeiten und Unterschiede auf der Grundlage der Struktur. Aber die meiste Zeit sind die chemischen Eigenschaften gleich, da es sich um die gleiche Verbindung handelt, die in verschiedenen Formen existiert. Aber die physikalischen Eigenschaften sind unterschiedlich. , CACO3 (Calciumcarbonat) existiert in einer orthorhombischen Form oder in hexagonaler Form.
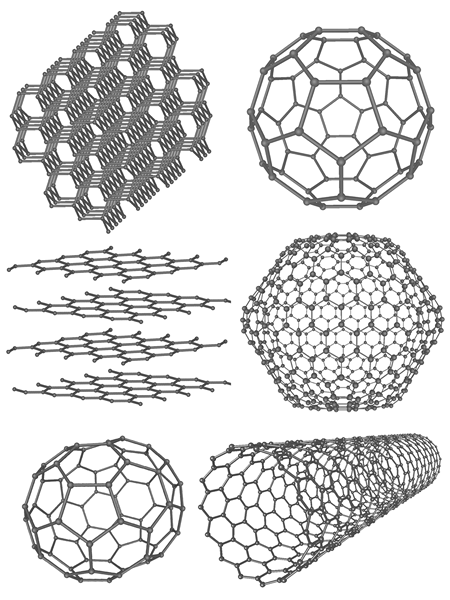
Abbildung 02: Kohlenstoffallotrope
Allotropie ist ein verwandter Begriff mit dem Polymorphismus. Allotropie bezieht sich auf den Polymorphismus eines bestimmten Elements. Die Verbindungen, die Allotropie zeigen. Allotrope treten auf, wenn ein Element eine kristalline Struktur mit unterschiedlichen Anordnungen bildet. Zum Beispiel Kohlenstoffform -Allotröpe wie Diamant oder Graphit. Diese Allotrope haben unterschiedliche chemische und physikalische Eigenschaften.
Was ist Unterschied zwischen Isomorphismus und Polymorphismus?
Isomorphismus gegen Polymorphismus | |
| Der Isomorphismus bezieht sich auf das Vorhandensein von zwei oder mehr Verbindungen mit identischen Morphologien. | Polymorphismus bezieht sich auf das Vorhandensein verschiedener Morphologien derselben Substanz. |
| Form | |
| Isomorphe Substanzen haben identische Formen. | Polymorphe Substanzen haben unterschiedliche Formen. |
| Verbindung | |
| Isomorphismus betrifft zwei oder mehr verschiedene Verbindungen. | Polymorphismus beschreibt die verschiedenen Formen derselben Verbindung oder desselben Elements. |
| In Elementen | |
| Isomorphismus fehlt in Elementen. | Polymorphismus ist in Elementen vorhanden. |
| Atomverhältnis | |
| Isomorphe Substanzen haben die gleiche Atomration in der empirischen Formel. | Polymorphe Substanzen weisen entweder ähnliche oder unterschiedliche Atomverhältnisse auf. |
Zusammenfassung - Isomorphismus vs Polymorphismus
Isomorphismus und Polymorphismus drücken zwei entgegengesetzte Ideen aus. Der Unterschied zwischen Isomorphismus und Polymorphismus besteht darin, dass sich Isomorphismus auf das Vorhandensein von zwei oder mehr Verbindungen mit identischen Morphologien bezieht, während sich Polymorphismus auf das Vorhandensein verschiedener Morphologien derselben Substanz bezieht.
Referenz:
1.„Kristallisation und Polymorphismus.American Chemical Society. Hier verfügbar
2.„Isomorphismus (Kristallographie).”Wikipedia, Wikimedia Foundation, 17. Februar. 2018. Hier verfügbar
3.„Allotropie.Wikipedia, Wikimedia Foundation, 3. März. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Caco3-Calcite-Struktur'by Tem5psu-eigene Arbeit, (CC BY-SA 4.0) über Commons Wikimedia (modifiziert)
2.'Natriumnitrat-Einheit-Cell-3D-Balls'By Ben Mills-eigene Arbeit, (Public Domain) über Commons Wikimedia (modifiziert)
3.'Allotrope von Carbon'by Mstroeck (Talk) (Uploads) - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia


