Unterschied zwischen Ionendipol- und Dipol -Dipolkräften

Schlüsselunterschied - Ionendipol vs Dipol Dipolkräfte
Intermolekulare Kräfte sind die Anziehungskräfte zwischen verschiedenen Molekülen. Ionen-Dipolkräfte und Dipol-Dipolkräfte sind zwei Formen intermolekularer Kräfte. Einige andere Beispiele für intermolekulare Kräfte sind ioneninduzierte Dipolkräfte, Wasserstoffbrückenbindungen und Van der Waal-Kräfte. Diese Kräfte sind elektrostatische Attraktionen, da die Moleküle aufgrund ihrer elektrischen Ladungen angezogen werden. Der Schlüsselunterschied Zwischen Ion-Dipol- und Dipol-Dipolkräften ist das Ionen-Dipolkräfte bestehen zwischen ionischen Spezies und polaren Molekülen, während zwischen polaren Molekülen Dipol-Dipolkräfte bestehen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Ionendipolkräfte
3. Was sind Dipol -Dipolkräfte
4. Ähnlichkeiten zwischen Ionendipol- und Dipol -Dipolkräften
5. Seite für Seitenvergleich - Ionendipol gegen Dipol -Dipolkräfte in tabellarischer Form
6. Zusammenfassung
Was sind Ionendipolkräfte?
Ionen-Dipolkräfte sind Anziehungskräfte zwischen ionischen Spezies und polaren Molekülen.Die ionische Spezies kann ein Anion (eine negativ geladene Art) oder ein Kation (eine positiv geladene Art) sein.Ein polares Molekül ist jedes Molekül, das eine permanente elektrische Ladungsabtrennung innerhalb des Moleküls aufgrund von Unterschieden zwischen den Elektronegativitätswerten der Atome in diesem Molekül aufweist. Elektronegativität ist die Fähigkeit, Elektronen anzuziehen. Wenn ein Atom mit einer hohen Elektronegativität an ein Atom mit einer geringen Elektronegativität gebunden ist, werden die Bindungselektronen durch das Atom mit hoher Elektronegativität angezogen (dann erhält es eine teilweise negative Ladung), was das weniger elektronegative Atom eine teilweise positive Ladung ergibt. Dieser Zustand der Ladungsetrennung wird als Polarisation bezeichnet und das Molekül als Polarmolekül bezeichnet.
Ionen-Dipolkräfte sind stärker als Dipol-Dipolkräfte. Dies liegt daran. Die Ionen-Dipol-Kräfte sind noch stärker als Wasserstoffbrückenbindung. Diese Wechselwirkung tritt aufgrund elektrostatischer Wechselwirkungen zwischen Ion und Dipol auf.
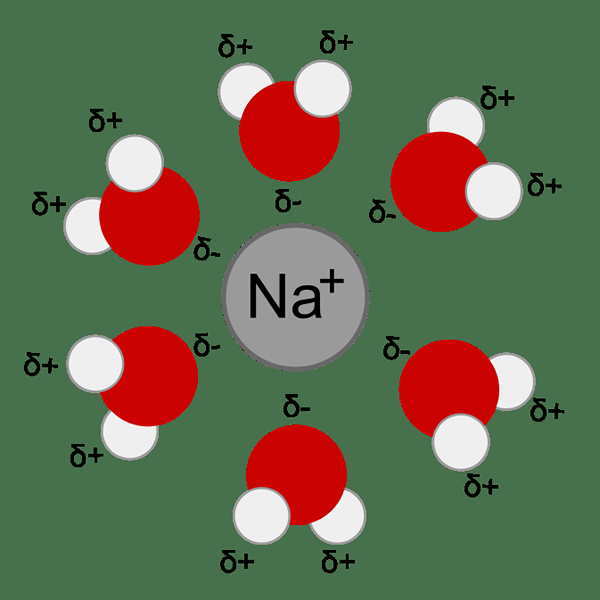
Abbildung 01: Die Hydratation von Metallionen erfolgt aufgrund der Anziehungskraft zwischen Metallionen- und Wassermolekülen (Dipol)
Eine Unterkategorie von Ion-Dipolkräften ist Ionen-induzierte Dipolkräfte, die ein unpolares Molekül anstelle eines polaren Moleküls beinhalten. Ein nichtpolares Molekül hat keinen Dipol (keine Ladungstrennung). Die Ladung des Ions bewirkt, dass das unpolare Molekül durch Verzerrung der Elektronenwolke des nichtpolaren Moleküls polarisiert wird.
Was sind Dipol -Dipolkräfte?
Dipol-Dipolkräfte sind intermolekulare Kräfte, die zwischen polaren Molekülen auftreten. Dies sind elektrostatische Kräfte. Bei der Bildung dieser Krafttyp werden die polaren Moleküle in der Regel ausgerichtet. Diese Ausrichtung reduziert auch die Abstoßungen zwischen den Molekülen.

Abbildung 02: Anziehungskraft zwischen polaren HCl -Molekülen
Wenn eine Reihe von Verbindungen mit ähnlichen Molmassen berücksichtigt wird (die Dipol-Dipol-Wechselwirkungskräfte zwischen Molekülen aufweisen). Das geschieht, denn wenn die Polarität hoch ist, bedeutet dies, dass die Ladungstrennung hoch ist. Wenn das Molekül eine hohe Ladungsabtrennung aufweist (hoch geladene positive und negative Anschlüsse im selben Molekül), zieht es tendenziell entgegengesetzte Ladungen stark an. Dies führt auch dazu, dass der Siedepunkt von Verbindungen erhöht wird. Größer die Dipol-Dipolkräfte, größer der Siedepunkt.
Was sind die Ähnlichkeiten zwischen Ionendipol- und Dipol -Dipolkräften?
- Sowohl Ionendipol- als auch Dipol -Dipolkräfte sind Arten intermolekularer Wechselwirkungen
- Sowohl Ionen -Dipol- als auch Dipol -Dipolkräfte sind elektrostatische Kräfte
Was ist der Unterschied zwischen Ionendipol- und Dipol -Dipolkräften?
Ion -Dipol gegen Dipol -Dipolkräfte | |
| Ionendipolkräfte sind attraktive Kräfte zwischen Ionischen Spezies und polaren Molekülen. | Dipol-Dipolkräfte sind intermolekulare Kräfte, die zwischen polaren Molekülen auftreten. |
| Stärke | |
| Ionen-Dipolkräfte sind stärker als Wasserstoffbrückenbindungen und Dipol-Dipolkräfte. | Dipol-Dipolkräfte sind schwächer als Wasserstoffbrückenbindungen und Ionentipolkräfte. |
| Komponenten | |
| Ionen-Dipolkräfte entstehen zwischen Ionen (Kationen oder Anionen) und polaren Molekülen. | Dipol-Dipolkräfte entstehen zwischen polaren Molekülen. |
Zusammenfassung - Ion -Dipol vs Dipol Dipolkräfte
Ionen-Dipolkräfte und Dipol-Dipolkräfte sind intermolekulare Kräfte, die zwischen verschiedenen chemischen Spezies wie Kationen, Anionen und polaren Molekülen bestehen. Polare Moleküle sind kovalente Verbindungen mit Dipolen (elektrische Ladungsabtrennungen). Ein polares Molekül hat ein positiv geladenes Terminal und ein negativ geladenes Terminal im selben Molekül. Daher können diese Klemmen elektrostatische Attraktionen mit entgegengesetzten Ladungen haben. Der Unterschied zwischen Ionen-Dipol- und Dipol-Dipolkräften besteht darin.
Referenz:
1.„11.3: Dipol-Dipolkräfte.”Chemie libretexten, libretexten, 11. Februar. 2018. Hier verfügbar
2.Dipol-Dipolkräfte. Hier verfügbar
3."Intermolekulare Kraft.Wikipedia, Wikimedia Foundation, 14. März. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Na+H2O'By Taxman (Public Domain) über Commons Wikimedia
2.'Dipole-Dipol-Interaktion-in-Hcl-2D'by Benjah-BMM27-eigene Arbeit, (Public Domain) über Commons Wikimedia


