Unterschied zwischen Isotopen und Elementen
Der Schlüsselunterschied zwischen Isotopen und Elementen ist, dass die Isotope sind unterschiedliche Formen des gleichen chemischen Elements, während die Elemente Atomespezies sind, die die gleiche Anzahl von Protonen in den Atomkern haben.
Eine ähnliche Art von Atomen kann geringfügige Veränderungen unterziehen, um unterschiedliche Isotope zu bilden. Ein Element kann mehrere Isotope haben. Die Natur jedes Isotops trägt zur Natur eines Elements bei. Hier werden wir ausführlich über die Isotope und Elemente diskutieren, um den Unterschied zwischen Isotopen und Elementen aufzuklären.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Isotope?
3. Was sind Elemente
4. Seite für Seitenvergleich - Isotope vs Elemente in tabellarischer Form
5. Zusammenfassung
Was sind Isotope??
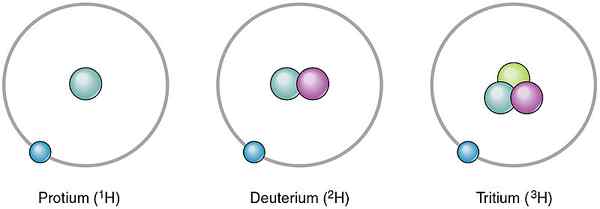
Atome desselben Elements können sich voneinander unterscheiden. Diese verschiedenen Atome desselben Elements sind Isotope. Sie unterscheiden sich voneinander, indem sie eine andere Anzahl von Neutronen haben. Da die Neutronenzahl unterschiedlich ist, unterscheidet sich auch ihre Massenzahl. Die Isotope desselben Elements haben jedoch die gleiche Anzahl von Protonen. In der Natur treten verschiedene Isotope in unterschiedlichen Mengen auf. Daher können wir ihr Vorkommen als prozentualer Wert geben, der als relative Häufigkeit bezeichnet wird. Zum Beispiel hat Wasserstoff drei Isotope wie Protium, Deuterium und Tritium. Die Anzahl der Protonen in ihren Atomkern ist gleich, aber die Anzahl der Neutronen ist unterschiedlich. Ihre Neutronen und relativen Häufigkeiten sind wie folgt.
- 1H - keine Neutronen, relative Häufigkeit beträgt 99.985%
- 2H-ein Neutron, relativer Häufigkeit ist 0.015%
- 3H- Zwei Neutronen, relative Häufigkeit beträgt 0%

Abbildung 01: Wasserstoffisotope
Die Anzahl der Neutronen, die ein Kern halten kann, unterscheidet sich von Element zu Element. Unter diesen Isotopen sind nur einige stabil. Zum Beispiel hat Sauerstoff drei stabile Isotope und Tin hat zehn stabile Isotope. In den meisten Fällen haben einfache Elemente die gleiche Neutronenzahl wie die Protonennummer. Aber in schweren Elementen gibt es mehr Neutronen als die Anzahl der Protonen.
Darüber hinaus ist die Anzahl der Neutronen wichtig, um die Stabilität der Kerne auszugleichen. Wenn die Kerne zu schwer sind, werden sie instabil und daher werden diese Isotope radioaktiv. Zum Beispiel, 238U emittiert Strahlung und zerfällt in viel kleinere Kerne. Isotope können aufgrund ihrer unterschiedlichen Massen unterschiedliche Eigenschaften haben. Zum Beispiel können sie unterschiedliche Spins haben. Somit unterscheiden sich ihre NMR -Spektren. Ihre Elektronenzahl ist jedoch ähnlich, was zu ähnlichem chemischem Verhalten führt.
Was sind Elemente?
Wir sind mit dem Wort „Element“ vertraut. Es gibt ungefähr 118 chemische Elemente in der Periodenzüchter, und sie sind gemäß ihrer Atomzahl angeordnet. Ein Element ist eine chemische Spezies, die nur eine einzelne Art von Atomen darstellt. Daher sind sie rein. Darüber hinaus haben die Atome des gleichen Elements die gleiche Anzahl von Protonen in ihren Atomkernen. Die Anzahl der Neutronen kann sich jedoch voneinander unterscheiden. Zum Beispiel ist das kleinste Element Wasserstoff. Silber, Gold, Platin sind einige der häufig bekannten kostbaren Elemente.
Jedes Element hat eine Atommasse, eine Atomzahl, Symbol, elektronische Konfiguration usw. Obwohl die meisten Elemente natürlich vorkommen, gibt es einige synthetische Elemente wie Californium, Americium, Einsteinium und Mendelevium. Wir können alle Elemente in drei Gruppen kategorisieren. als Metalle, Metalloide und Nichtmetalle.
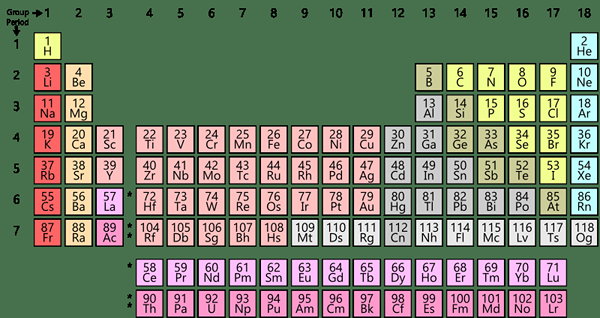
Abbildung 02: Endoskelett
Darüber hinaus können wir sie in Gruppen und Perioden einbeziehen, die auf spezifischeren Merkmalen basieren. Außerdem haben Elemente in derselben Gruppe oder in derselben Zeit bestimmte gemeinsame Merkmale, und einige Eigenschaften können sich nacheinander ändern, wenn Sie eine Gruppe oder eine Periode durchlaufen. Darüber hinaus können Elemente chemische Veränderungen unterzogen werden, um verschiedene Verbindungen zu bilden. Wir können jedoch keine Elemente mit einfachen chemischen Methoden weiter auflösen.
Was ist der Unterschied zwischen Isotopen und Elementen?
Der Begriff Chemisches Element beschreibt eine Atomespezies, während der Begriff Isotope verschiedene Formen desselben chemischen Elements beschreibt. Daher besteht der Hauptunterschied zwischen Isotopen und Elementen darin, dass Isotope unterschiedliche Formen des gleichen chemischen Elements sind, während Elemente Arten von Atomen sind, die die gleiche Anzahl von Protonen in den Atomkern haben. Darüber hinaus besteht ein weiterer Unterschied zwischen Isotopen und Elementen darin, dass die Isotope unterschiedliche Anzahl von Neutronen haben, chemische Elemente entweder die gleiche Anzahl von Neutronen oder eine andere Anzahl von Neutronen haben können. aber sie haben nie die gleiche Anzahl von Protonen.
Als ein weiterer wichtiger Unterschied zwischen Isotopen und Elementen können wir sagen, dass die Atommasse eines Isotops berechnet werden kann, indem einfach die Gesamtmasse von Protonen und die Neutronen in den Atomkern hinzuge Massen seiner Isotope und ihrer relativen Fülle.

Zusammenfassung -Isotope gegen Elemente
Isotope sind unterschiedliche Atomformen desselben chemischen Elements. Der Hauptunterschied zwischen Isotopen und Elementen besteht darin, dass die Isotope unterschiedliche Formen des gleichen chemischen Elements sind, während die Elemente Arten von Atomen sind, die die gleiche Anzahl von Protonen in den Atomkern haben.
Referenz:
1. "Chemisches Element.Wikipedia, Wikimedia Foundation, 11. November. 2018. Hier verfügbar
2. Helmenstine, Anne Marie, ph.D. „Definition und Beispiele in der Chemie Isotopes Definition und Beispiele in der Chemie.”Thoughtco, Oktober. 22, 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”204 Isotope von Wasserstoff -01" von OpenStax College - Anatomy & Physiology, Connexions Website. (CC von 3.0) über Commons Wikimedia
2."Einfacher periodischer Tabellen -Chart -en" von Offnfopt - eigener Arbeit, (Public Domain) über Commons Wikimedia


