Unterschied zwischen Isotopen und Isomeren

Isotope gegen Isomere
Es gibt Variationen zwischen verschiedenen Atomen. Es gibt auch Variationen innerhalb derselben Elemente. Isotope sind Beispiele für Unterschiede innerhalb eines einzelnen Elements.
Ein Molekül oder ein Ion mit derselben molekularen Formel kann auf unterschiedliche Weise existieren, abhängig von den Bindungsaufträgen, den Unterschieden der Ladungsverteilung, der Art und Weise, wie sie sich im Raum usw. usw. anordnen; Diese sind als Isomere bekannt.
Isotope
Atome desselben Elements können unterschiedlich sein. Diese verschiedenen Atome desselben Elements werden Isotope bezeichnet. Sie unterscheiden sich voneinander, indem sie eine unterschiedliche Anzahl von Neutronen haben. Da die Neutronenzahl unterschiedlich ist, unterscheidet sich auch ihre Massenzahl. Die Isotope desselben Elements haben jedoch die gleiche Anzahl von Protonen und Neutronen. Verschiedene Isotope in unterschiedlichen Mengen, und dies wird als prozentualer Wert angegeben, der als relative Häufigkeit bezeichnet wird. Zum Beispiel hat Wasserstoff drei Isotope wie Protium, Deuterium und Tritium. Ihre Anzahl von Neutronen und relativen Häufigkeiten ist wie folgt.
1H - keine Neutronen, relative Häufigkeit beträgt 99.985%
2H-ein Neutron, relativer Häufigkeit ist 0.015%
3H- Zwei Neutronen, relative Häufigkeit beträgt 0%
Die Anzahl der Neutronen, die ein Kern halten kann, unterscheidet sich von Element zu Element. Unter diesen Isotopen sind nur einige stabil. Zum Beispiel hat Sauerstoff drei stabile Isotope und Tin hat zehn stabile Isotope. Meistens haben einfache Elemente die gleiche Neutronenzahl wie die Protonenzahl, aber in schweren Elementen gibt es mehr Neutronen als die Protonen. Die Anzahl der Neutronen ist wichtig, um die Stabilität der Kerne auszugleichen. Wenn die Kerne zu schwer sind, werden sie instabil und daher werden diese Isotope radioaktiv. Zum Beispiel, 238 U emittiert Strahlung und Zerfälle auf viel kleinere Kerne. Isotope können aufgrund ihrer unterschiedlichen Massen unterschiedliche Eigenschaften haben. Zum Beispiel können sie unterschiedliche Spins haben, daher unterscheidet sich ihre NMR -Spektren. Ihre Elektronenzahl ist jedoch ähnlich, was zu einem ähnlichen chemischen Verhalten führt.
Ein Massenspektrometer kann verwendet werden, um Informationen über Isotope zu erhalten. Es gibt die Anzahl der Isotope, die ein Element hat, ihre relativen Häufigkeiten und Massen.
Isomere
Isomere sind unterschiedliche Verbindungen mit der gleichen molekularen Formel. Es gibt verschiedene Arten von Isomeren. Isomere können hauptsächlich in zwei Gruppen als konstitutionelle Isomere und Stereo -Isomere unterteilt werden. Konstitutionelle Isomere sind Isomere, bei denen sich die Konnektivität von Atomen in Molekülen unterscheidet. Butan ist der einfachste Alkane, der konstitutionelle Isomerismus zeigt. Butan hat zwei konstitutionelle Isomere, Butan selbst und Isobuten.
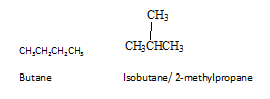
In Stereoisomeren sind Atome in derselben Sequenz verbunden, im Gegensatz zu konstitutionellen Isomeren. Stereoisomere unterscheiden sich nur in der Anordnung ihrer Atome im Weltraum. Stereoisomere können zwei Arten, Enantiomere und Diastereomere sein. Diastereomere sind Stereoisomere, deren Moleküle nicht die Spiegelbilder voneinander sind. Die CIS-Trans-Isomere von 1,2-Dichlorethen sind Diastereomere. Enantiomere sind Stereoisomere, deren Moleküle nicht überprüfbare Spiegelbilder voneinander sind. Enantiomere treten nur mit chiralen Molekülen auf. Ein chirales Molekül ist definiert als eines, das nicht mit seinem Spiegelbild identisch ist. Daher sind das chirale Molekül und sein Spiegelbild Enantiomere voneinander. Zum Beispiel ist 2-Butanol-Molekül chiral, und es und seine Spiegelbilder sind Enantiomere.
| Was ist der Unterschied zwischen Isotope und Isomere? • Isotope sind unterschiedliche Atome desselben Elements. Isomere sind unterschiedliche Verbindungen mit der gleichen molekularen Formel. • Isotope unterscheiden sich aufgrund der Anzahl der Neutronen voneinander, während sich Isomere aufgrund der Anordnung von Atomen voneinander unterscheiden. • Isotope eines einzelnen Elements haben das gleiche chemische Verhalten, aber die physikalischen Eigenschaften können sich unterscheiden. Isomere mit der gleichen chemischen Formel haben Unterschiede sowohl in chemischen als auch in physikalischen Eigenschaften (mit Ausnahme einiger Isomere). |


