Unterschied zwischen dem Gesetz der ständigen Zusammensetzung und des Gesetzes mehrerer Ausmaße
Der Schlüsselunterschied Zwischen dem Gesetz der ständigen Zusammensetzung und dem Gesetz mehrerer Ausmaße ist das, dass Nach dem Gesetz der konstanten Zusammensetzung besteht der gleiche Anteil der Proben immer aus demselben Anteil der Elemente nach Masse, während nach dem Gesetz mehrerer Anteile zwei Elemente miteinander binden, die mehr als eine chemische Verbindung bilden, dann das Verhältnis Zwischen den Massen des zweiten Elements, das sich mit einer festen Masse des ersten Elements verbindet.
Das Gesetz ständiger Zusammensetzungen und des Gesetzes mehrerer Ausmaße sind Theorien in der physikalischen Chemie, die zur Erklärung der Stöchiometrie in der Chemie verwendet werden. Stöchiometrie ist das Maß für die relativen Mengen von Reaktanten und Produkten in einer chemischen Reaktion.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist das Gesetz der ständigen Komposition
3. Was ist das Gesetz mehrerer Ausmaße
4. Seite für Seitenvergleich - Gesetz der ständigen Zusammensetzung im Vergleich zu mehreren Anteilen in tabellarischer Form
5. Zusammenfassung
Was ist das Gesetz der ständigen Komposition?
Das Gesetz der ständigen Zusammensetzungszustände einer Verbindung enthält immer den gleichen Anteil an Elementen durch Masse. Wir können dieses Gesetz auch als Gesetz der eindeutigen Ausmaße nennen. Dieses Gesetz beschreibt, dass eine bestimmte Verbindung immer die gleichen Elemente in denselben Proportionen mit der Masse enthält.
Zum Beispiel, sei es Leitungswasser oder Meerwasser, ein Wassermolekül enthält immer Wasserstoff- und Sauerstoffelemente in den folgenden Anteilen. Die chemische Formel eines Wassermoleküls ist H2O, und die Molmasse dieses Moleküls beträgt 18 g/mol. Daher enthält ein Wassermol Wasser 18 g H2O. Das Verhältnis zwischen H und O im Wassermolekül beträgt 2: 1. Dementsprechend der Massenanteil von Wasserstoff in Wasser = (2g / 18g) x 100% = 11.11% und der Massenanteil von Sauerstoff = (16G/18G) x 100% = 88.89%. Diese Fraktionen sind konstant und verändern sich nicht entsprechend der Wasserquelle und der Trennungsmethode.
Das Gesetz der ständigen Zusammensetzung hängt von der Tatsache ab, dass jedes Atom desselben Elements (Atome mit derselben Atomzahl) ähnlich ist. In Anbetracht des obigen Beispiels wird davon ausgegangen, dass jedes Wasserstoffatom einem anderen Wasserstoffatom ähnlich ist und umgekehrt. Aber es kann auch einige Ausnahmen geben. E.G. Die isotopische Zusammensetzung eines Elements kann je nach Quelle variieren. Daher zeigt die Stöchiometrie Variationen abhängig von der Elementquelle.
Was ist das Gesetz mehrerer Ausmaße?
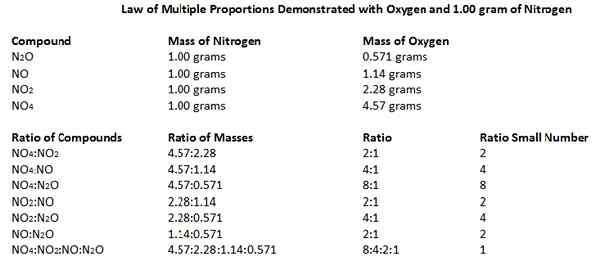
Das Gesetz mehrerer Proportionen besagt, dass, wenn sich zwei Elemente zu mehr als einer Verbindung miteinander verbinden, die Gewichte eines Elements, die sich mit einem festen Gewicht des anderen verbinden.

Wir können dieses Gesetz auch Daltons Gesetz nennen, weil das Gesetz 1803 von John Dalton entwickelt wurde. Lassen Sie uns dieses Gesetz anhand eines Beispiels verstehen.
Stickoxide bestehen aus Stickstoff- und Sauerstoffatomen. Wir können fünf verschiedene Stickstoffoxide identifizieren: n2O, nein, n2Ö3, NEIN2 und n2Ö5. In Anbetracht der Massenverhältnisse von N und O in diesen Oxidverbindungen verbinden sich 14 Gramm Stickstoffatom mit 8, 16, 24, 32 und 40 Gramm Sauerstoff gemäß dem Massenverhältnis. Wenn wir diese Zahlen als kleine, ganze Zahlen betrachten, können die Verhältnisse als 1: 1, 1: 2, 1: 3, 1: 4 und 1: 5 angegeben werden.
Was ist der Unterschied zwischen dem Gesetz der ständigen Zusammensetzung und dem Gesetz mehrerer Ausmaße?
Nach dem Gesetz der konstanten Zusammensetzung besteht der gleiche Anteil der Proben immer aus demselben Anteil der Elemente nach Masse, während nach dem Gesetz mehrerer Anteile, wenn zwei Elemente miteinander binden, die mehr als ein chemischer Verbindungen bilden, dann das Verhältnis Zwischen den Massen des zweiten Elements, das sich mit einer festen Masse des ersten Elements verbindet. Dies ist also der Schlüsselunterschied zwischen dem Gesetz der ständigen Zusammensetzung und dem Gesetz mehrerer Anteile.

Zusammenfassung -Gesetz der ständigen Zusammensetzung gegen das Gesetz mehrerer Ausmaße
Nach dem Gesetz der konstanten Zusammensetzung besteht der gleiche Anteil der Proben immer aus demselben Anteil der Elemente nach Masse, während nach dem Gesetz mehrerer Anteile, wenn zwei Elemente miteinander binden, die mehr als ein chemischer Verbindungen bilden, dann das Verhältnis Zwischen den Massen des zweiten Elements, das sich mit einer festen Masse des ersten Elements verbindet. Dies ist daher der Unterschied zwischen dem Gesetz der ständigen Zusammensetzung und dem Gesetz mehrerer Anteile.
Referenz:
1. Helmenstine, Anne Marie. „Gesetz der ständigen Zusammensetzung in der Chemie.”Thoughtco, August. 26, 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Demonstration des Gesetzes mehrerer Ausmaße" von Kenji Agari - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


