Unterschied zwischen begrenztem Reaktant und überschüssigem Reaktant
Der Schlüsselunterschied Zwischen dem begrenzenden Reaktanten und dem überschüssigen Reaktant ist das Der limitierende Reaktant kann die Menge des produzierten Endprodukts einschränken, während der Überschussreaktant keinen Einfluss auf die Höhe des Endprodukts hat.
Ein Reaktant ist eine Verbindung, die während einer chemischen Reaktion konsumiert wird. Eine chemische Reaktion umfasst Reaktanten - einige Reaktanten im Übermaß und einige in begrenzten Mengen. Der limitierende Reaktant entscheidet immer die Menge des nach Abschlusss der Reaktion gebildeten Endprodukts. Das bedeutet, dass der limitierende Reaktant die Höhe des Endprodukts begrenzt, aber es gibt keinen solchen Effekt durch den überschüssigen Reaktanten.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist ein begrenzender Reaktant
3. Was ist übermäßiger Reaktant
4. Seite für Seitenvergleich -Einschränkender Reaktant gegenüber überschüssigem Reaktant in tabellarischer Form
5. Zusammenfassung
Was ist ein begrenzender Reaktant?
Einschränkender Reaktant ist der Reaktant einer bestimmten chemischen Reaktion, die die Bildung des Endprodukts begrenzen kann. Daher entscheidet es, wie viel Produkt wir aus der Fertigstellung der chemischen Reaktion ergeben können. Darüber hinaus wird dieser Reaktant während der Reaktion vollständig verbraucht. Die Reaktion stoppt, wenn der gesamte begrenzende Reaktant verzehrt wird. Es liegt daran, dass die Reaktion aufhört, wenn ein Reaktant fehlt.

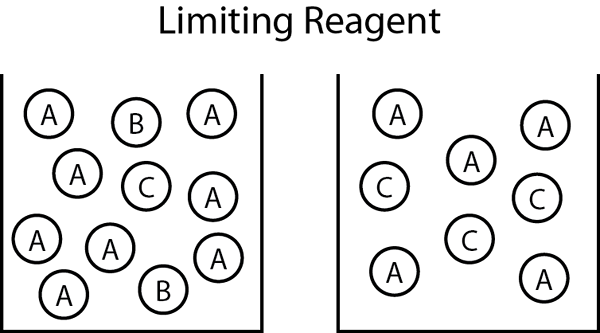
Abbildung 01: Wenn ein begrenzender Reaktant b ist und das Endprodukt C ist, während überschüssiger Reaktant a ist, enthält das endgültige Reaktionsgemisch a und c.
Durch die Betrachtung der stöchiometrischen Beziehung zwischen diesem Reaktanten und dem Endprodukt in einer chemischen Gleichung können wir bestimmen, wie viel Produkt gebildet werden soll.
Was ist übermäßiger Reaktant?
Ein überschüssiger Reaktant ist der Reaktant, der in einem Reaktionsgemisch im Übermaß vorhanden ist. Daher bleibt nach Abschluss der Reaktion noch ein gewisser Betrag dieses Reaktanten, da sie im Überschuss liegt. Wir können das Vorhandensein eines überschüssigen Reaktanten zu Beginn der Reaktion, beim Fortschreiten und am Ende auch beobachten. Manchmal ist das Vorhandensein eines überschüssigen Reaktanten wichtig, um eine unbekannte Menge einer bestimmten Substanz zu bestimmen, die mit diesem überschüssigen Reaktanten reagieren kann. Beispielsweise verwenden wir bei titrimetrischen Methoden einen überschüssigen Reaktanten mit einer bekannten Menge und nach Abschluss der Reaktion. Hier können wir die Menge an überschüssigem Reaktanten bestimmen, die noch im Reaktionsgemisch vorhanden sind, um festzustellen, wie viel von diesem Reaktanten mit dem Unbekannten reagiert wurde.
Was ist der Unterschied zwischen begrenzender Reaktanten und überschüssigem Reaktant?
Der limitierende Reaktant und der überschüssige Reaktant sind bei einer chemischen Reaktion wichtig. Der Schlüsselunterschied zwischen dem Grenzreaktanten und dem überschüssigen Reaktanten besteht darin, dass der limitierende Reaktant die Menge des produzierten Endprodukts begrenzen kann.
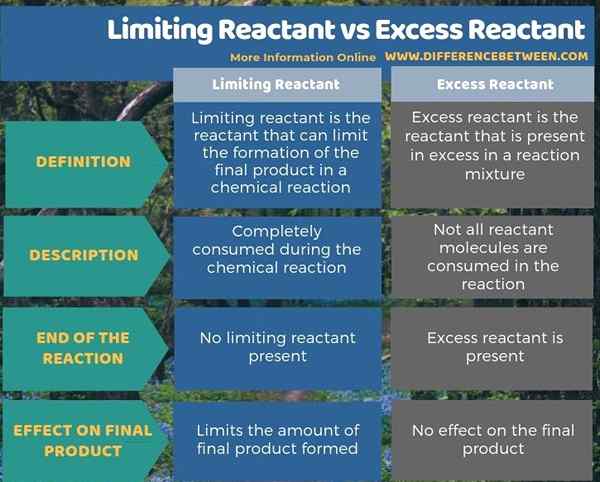
Die folgende Infografik zeigt mehr Fakten zum Unterschied zwischen begrenzender Reaktanten und überschüssigem Reaktant.
Zusammenfassung -Begrenzung des Reaktanten im Vergleich zum Überschussreaktanten
Der limitierende Reaktant und der überschüssige Reaktant sind bei einer chemischen Reaktion wichtig. Ein limitierender Reaktant kann die Menge des produzierten Endprodukts einschränken, während überschüssiger Reaktant keinen Einfluss auf die Höhe des Endprodukts hat. Daher ist dies der Schlüsselunterschied zwischen begrenzender Reaktanten und überschüssigem Reaktant
Referenz:
1. „Übermäßige und begrenzte Reagenzien.” Chemie -Libretexten, Libretexten, 5. Juni 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Limiting Reagent" vom Brazosport College - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


