Unterschied zwischen Lysin und L-Lysin
Schlüsselunterschied - Lysin gegen L -Lysin
Lysin und L-Lysin sind beide Arten von Aminosäuren, die die gleichen physikalischen Eigenschaften teilen, es gibt einen gewissen Unterschied zwischen ihnen. Der Der Schlüsselunterschied zwischen Lysin und L-Lysin besteht in der Fähigkeit, das polarisierte Licht zu drehen. Lysin ist eine biologisch aktive von Natur aus vorkommende essentielle α-Aminosäure. Es kann in zwei isomeren Formen auftreten, da zwei verschiedene Enantiomere um das chirale Kohlenstoffatom bilden können. Diese sind als L- und D-Formen bekannt, analog zu linkshändigen und rechtshändigen Konfigurationen. Diese L- und D-Formen sollen optisch aktiv sein und in unterschiedlichem Sinne das polarisierte Licht polarisiertes Licht drehen. im Uhrzeigersinn oder gegen den Uhrzeigersinn. Wenn sich das Licht gegen den Uhrzeigersinn gegen Lysin dreht, weist das Licht eine Vorspeise auf und ist als L-Lysin bekannt. Es sollte jedoch sorgfältig festgestellt werden.
Was ist Lysin?
Lysin ist ein Essentielle Aminosäure welches ist nicht in unserem Körper synthetisiert und muss von der regulären Ernährung geliefert werden. Daher ist Lysin eine essentielle Aminosäure für den Menschen. Es ist eine biologisch wichtige organische Verbindung, die aus Amin besteht (-nh2) und Carbonsäure (-COOH) funktionelle Gruppen mit chemischer Formel NH2-(CH2)4-Ch (NH2) -COOH. Die Schlüsselelemente von Lysin sind Kohlenstoff, Wasserstoff, Sauerstoff und Stickstoff. In der Biochemie werden Aminosäuren mit dem am ersten (Alpha-) Kohlenstoffatom befestigten Carbonsäuregruppen als Karbonsäuregruppen bekannt als bekannt als α-Aminosäuren. Somit wird Lysin auch als α-Aminosäuren angesehen. Die Struktur von Lysin ist in Abbildung 1 angegeben.
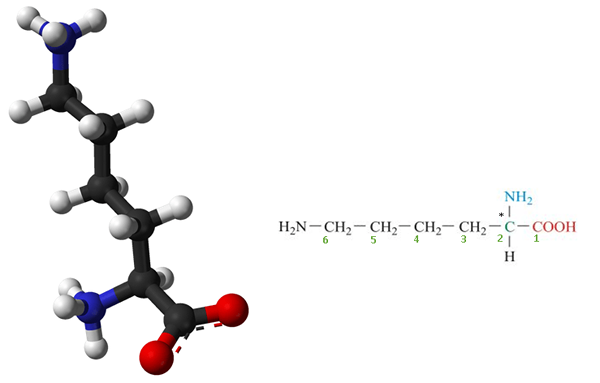
Abbildung 1: Molekulare Struktur von Lysin (* Kohlenstoffatom ist ein chirales oder asymmetrisches Kohlenstoffatom und repräsentiert auch das Alpha-Kohlenstoff-Atom)
Lysin ist grundlegender Natur, da sie zwei grundlegende Aminogruppen und eine saure Carboxylsäuregruppe enthält. Daher bildet es aufgrund des Vorhandenseins von zwei Aminogruppen auch eine umfangreiche Wasserstoffbrückebindung. Gute Lysinquellen sind proteinreiche tierische Quellen wie z Eier, rotes Fleisch, Lamm, Schweinefleisch und Geflügel, Käse und bestimmte Fische (wie Kabeljau und Sardinen). Lysin ist auch reich an Pflanzenproteinen wie Soja, Bohnen und Erbsen. Es ist jedoch eine einschränkende Aminosäure in den meisten Getreidekörnern, ist jedoch in den meisten Impulsen und Hülsenfrüchten reichlich vorhanden.
Was ist L-Lysin?
Lysin hat vier verschiedene Gruppen um die 2nd Kohlenstoff, und es ist Asymmetrische Struktur. Außerdem ist Lysin aufgrund des Vorhandensein dieses asymmetrischen oder chiralen Kohlenstoffatoms eine optisch aktive Aminosäure. Daher kann Lysin Stereoisomere erzeugen. Enantiomere sind zwei Stereoisomere, die durch eine Reflexion miteinander verwandt sind oder Spiegelbilder voneinander, die nicht superimposbar sind. Lysin ist in zwei enantiomeren Formen erhältlich, die als L- und D- und die Enantiomere von Lysin bekannt sind.

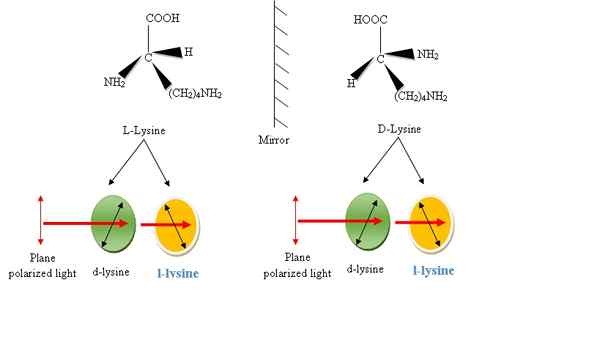
Abbildung 2: Enantiomere von Lysinaminosäure. Die Gruppen COOH, H, R und NH2 sind im Uhrzeigersinn im Uhrzeigersinn um das C-Atom angeordnet, das Enantiomer wird als L-Form bezeichnet und sonst d-Form. L- und D- beziehen sich nur auf die räumliche Anordnung um das Kohlenstoffatom und beziehen sich nicht auf die optische Aktivität. Während die L- und D-Formen eines chiralen Moleküls die Ebene des polarisierten Lichts in unterschiedliche Richtungen drehen (Dextro oder D- Form). L- und D-Formen werden als optische Isomere bezeichnet.
L-Lysin und D-Lysin sind Enantiomere voneinander haben die gleichen physikalischen Eigenschaften, mit Ausnahme der Richtung, in die sie polarisiertes Licht drehen. Sie haben eine nicht superimpusbare Spiegelbildbeziehung. Die Nomenklatur von D und L ist jedoch bei Aminosäuren einschließlich Lysin nicht üblich. Sie drehen das ebene polarisierte Licht in der gleichen Größe, aber in unterschiedliche Richtungen. Das D- und L-Isomer von Lysin, das das ebene polarisierte Licht im Uhrzeigersinn dreht, wird als dextrorotatorisch bezeichnet oder D-Lysin und das, das das ebene polarisierte Licht im gegen den Uhrzeigersinn gedrehten Richtung als LaeVorotatory oder bezeichnet hat oder L-Lysin (Figur 2).
L-Lysin ist das Die meisten verfügbaren stabilen Form von Lysin. D-Lysin ist eine synthetische Form von Lysin und kann durch Racemisierung aus L-Lysin synthetisiert werden. Es wird bei der Verarbeitung von Poly-D-Lysin verwendet, das als Beschichtungsmaterial verwendet wird, um den Zellansatz zu verbessern. L-Lysin spielt eine signifikante Rolle im menschlichen Körper, bei der Calciumabsorption, im Muskelproteinentwicklung und der Synthese von Hormonen, Enzymen und Antikörpern. Industriell wird L-Lysin durch einen mikrobiellen Fermentationsprozess verwendet CoryNebacterium glutamicum.
Was ist der Unterschied zwischen Lysin und L-Lysin?
Lysin und L-Lysin haben die gleichen physikalischen Eigenschaften, mit Ausnahme der Richtung, in die sie polarisiertes Licht drehen. Infolgedessen kann L-Lysin wesentlich unterschiedliche biologische Wirkungen und funktionelle Eigenschaften haben. Es wurden jedoch nur sehr begrenzte Untersuchungen durchgeführt, um diese biologischen Effekte und funktionellen Eigenschaften zu unterscheiden. Einige dieser Unterschiede können umfassen,
Schmecken
L-Lysin: L-Formen von Aminosäuren sind in der Regel geschmacklos.
D-Lysin: D-Formen von Aminosäuren schmecken dazu, süß zu schmecken.
Daher kann L-Lysin weniger/nicht süßer sein als Lysin.
Fülle
L-Lysin: Die L-Formen von Aminosäure einschließlich L-Lysin sind die am häufigsten vorkommende Form in der Natur. Als Beispiel sind neun der neunzehn L-Aminosäuren, die häufig in Proteinen vorkommen.
D-Lysin: Es wurde festgestellt, dass die d-Formen von Aminosäuren, die experimentell beobachtet wurden.
Referenzen: Solomonen, t.W. Graham und Graig B. Fryhle (2004). Organische Chemie (8th ed). Hoboken: John Wiley & Sons, Inc. Everhardus, a. (1984). Stereochemie, eine Grundlage für hochentwickelten Unsinn in der Pharmakokinetik und klinischer Pharmakologie, Europäisches Journal of Clinical Pharmacology, 26, 663-668. Bild mit freundlicher Genehmigung: „L-Lysin-Monocation-From-Hydrochlorid-Dihydrat-X-3D-Balls“ von Ben Mills-eigene Arbeit über Wikimedia Commons


