Unterschied zwischen Methan und Ethan

Schlüsselunterschied - Methan gegen Ethan
Methan und Ethan sind die kleinsten Mitglieder der Alkane -Familie. Die molekularen Formeln dieser beiden organischen Verbindungen sind CH4 und C2H6 bzw. Der Schlüsselunterschied zwischen Methan und Ethan ist ihre chemische Struktur; Ein Ethanmolekül kann als zwei Methylgruppen angesehen werden, die als Dimer von Methylgruppen verbunden sind. Die anderen chemischen und physikalischen Unterschiede ergeben sich hauptsächlich aufgrund dieses strukturellen Unterschieds.
Was ist Methan?
Methan ist das kleinste Mitglied der Alkanefamilie mit der chemischen Formel Ch4 (Vier Wasserstoffatome sind an ein Kohlenstoffatom gebunden). Es wird als Hauptkomponente von Erdgas angesehen. Methan ist ein farbloses, geruchloses und geschmackloses Gas; auch bekannt als Carbane, Sumpfgas, Erdgas, Kohlenstoff -Tetrahydrid, Und Wasserstoffkarbid. Es kann leicht entzündet werden und sein Dampf ist leichter als die Luft.
Methan ist natürlich unter dem Boden und unter dem Meeresboden zu finden. Das atmosphärische Methan wird als Treibhausgas betrachtet. Methan bricht in CH zusammen3- mit Wasser in der Atmosphäre. 
Was ist Ethan?
Ethan ist eine farblose, geruchlose gasförmige Verbindung bei Standardtemperatur und Druck. Seine molekulare Formel und sein Molekulargewicht sind c2H6 und 30.07 g · mol–1 bzw. Es ist aus Erdgas als Nebenprodukt aus dem Erdöl -Raffinerie isoliert. Ethan ist sehr wichtig in der Ethylenproduktion. 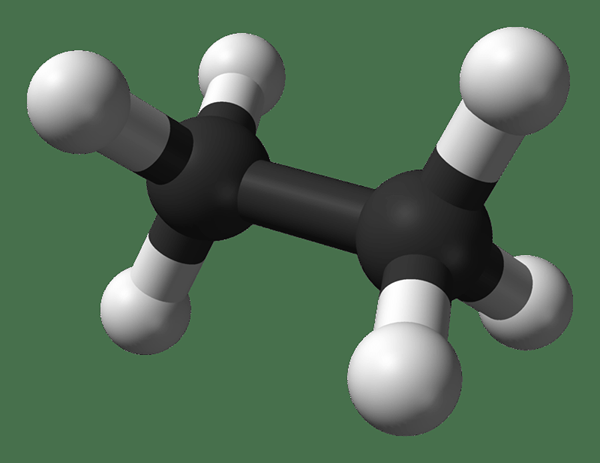
Was ist der Unterschied zwischen Methan und Ethan?
Merkmale von Methan und Ethan
Struktur:
Methan: Der Molekularformel von Methan ist CH4, und es ist ein Beispiel für ein tetraedrisches Molekül mit vier äquivalenten C-H-Bindungen (Sigma-Bindungen). Bindungswinkel zwischen H-C-H-Atomen beträgt 109.50 und alle C-H-Bindungen sind gleichwertig und sind gleich 108.190 Uhr.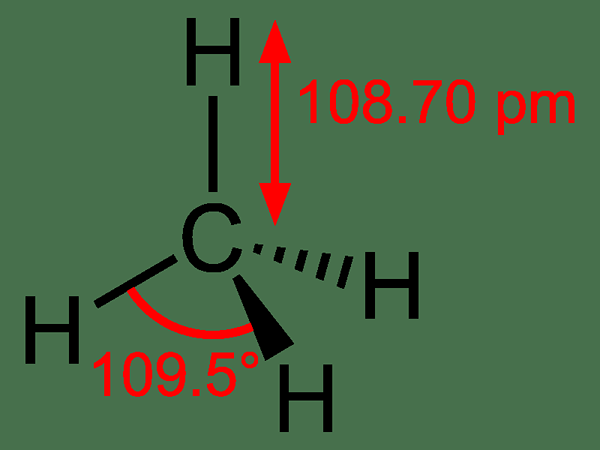
Ethan: Der Molekülformel von Ethan Ist C2H6, Und es ist ein gesättigter Kohlenwasserstoff, da es nicht mehrere Bindungen enthält.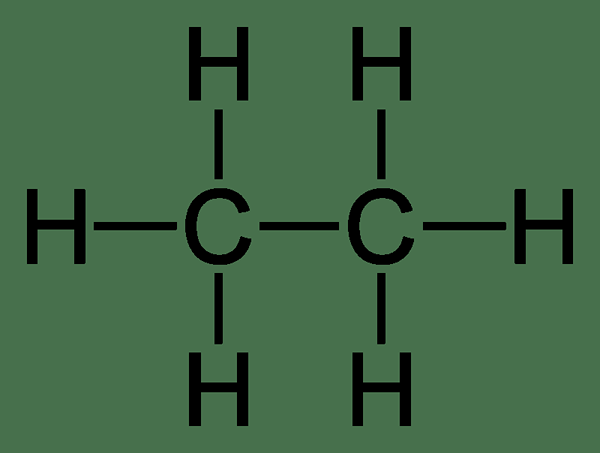
Chemische Eigenschaften:
Methan:
Stabilität: Methan ist ein chemisch sehr stabiles Molekül, das nicht mit KMNO reagiert4, K2Cr2Ö7, H2SO4 oder hno3 unter normalen Bedingungen.
Verbrennung: In Gegenwart von überschüssiger Luft oder Sauerstoff verbrennt Methan mit einer hellblauen nicht luminösen Flamme, die Kohlendioxid und Wasser erzeugt. Es ist eine sehr exotherme Reaktion; Daher wird es als ausgezeichneter Kraftstoff verwendet. In Gegenwart von unzureichender Luft oder Sauerstoff verbrennt es teilweise in Kohlenmonoxid (CO) -Gas.
Substitutionsreaktionen: Methan zeigt Substitutionsreaktionen mit Halogenen. Bei diesen Reaktionen werden ein oder mehrere Wasserstoffatome durch eine gleiche Anzahl von Halogenatomen ersetzt und als „Halogenierung“ bezeichnet.Es reagiert mit Chlor (CL) und Brom (BR) in Gegenwart von Sonnenlicht.
Reaktion mit Dampf: Wenn eine Mischung aus Methan und Dampf durch ein erhitztes (1000 K) Nickel geleitet wird, das auf der Aluminiumoxidoberfläche getragen wird, kann es Wasserstoff erzeugen.
Pyrolyse: Wenn Methan auf etwa 1300 K erhitzt wird, wird es auf Carbonschwarz und Wasserstoff zersetzt.
Ethan:
Reaktionen: Ethangas (CH3CH3) reagiert mit Bromdampf in Gegenwart von Licht, um Bromoethan zu bilden (CH3CH2Br) und Wasserstoffbromid (HBR). Es ist eine Substitutionsreaktion; Ein Wasserstoffatom in Ethan wird durch Bromatom ersetzt.
CH3CH3 + Br2 à ch3CH2BR +HBR
Verbrennung: Die vollständige Verbrennung von Ethan produziert 1559.7 kJ/mol (51.9 kj/g) Wärme, Kohlendioxid und Wasser.
2 c2H6 + 7 Ö2 → 4 CO2 + 6 H2Ö + 3120 KJ
Es kann auch ohne einen Sauerstoffüberschuss auftreten, der eine Mischung aus amorphem Kohlenstoff und Kohlenmonoxid erzeugt.
2 c2H6 + 3 Ö2 → 4 C + 6 H2Ö + Energie
2 c2H6 + 5 Ö2 → 4 Co + 6 H2Ö + Energie
2 c2H6 + 4 Ö2 → 2 C + 2 CO + 6 H2Ö + Energie usw.
Definitionen:
Substitutionsreaktionen: Die Substitutionsreaktion ist eine chemische Reaktion, die die Verschiebung einer funktionellen Gruppe in einer chemischen Verbindung beinhaltet und sie ersetzt von eine andere funktionale Gruppe.
Verwendet:
Methan: Methan wird in vielen industriellen chemischen Prozessen (als Kraftstoff, Erdgas, verflüssigtes Erdgas) verwendet und als gekühlte Flüssigkeit transportiert.
Ethan: Ethane wird als Kraftstoff für Motoren und als Kältemittel für ein extrem niedriges Temperatursystem verwendet. Es wird in Stahlzylindern als verflüssigtes Gas unter seinem eigenen Dampfdruck verschifft.
Referenzen: "Ethane". Wikipedia. N.P., 2016. Netz. 7. Juni 2016. Khanna, Bhism. „Was sind die chemischen Eigenschaften von Methan? ?”. Konservierungen.com. N.P., 2016. Netz. 7. Juni 2016. „Methan | CH4 - Pubchem ”. Pubchem.NCBI.NLM.NIH.Regierung. N.P., 2016. Netz. 7. Juni 2016. "Methan". Wikipedia. N.P., 2016. Netz. 7. Juni 2016. Bild mit freundlicher Genehmigung: „Ball-and-Stick-Modell des Methanmoleküls“ von (Public Domain) über Commons Wikimedia „Ball-and-Stick-Modell von Ethanmolekül“ y Ben Mills-eigene Arbeit (Public Domain) über Commons Wikimedia „Methane“ von von „Methane“ von Jynto-eigene Arbeit, basierend auf Datei: Methan-CRC-MW-Dimensions-2D.PNG, (Public Domain) über Commons Wikimedia „Ethane“ (Public Domain) über Commons Wikimedia

