Unterschied zwischen molekularer Bewegung und Diffusion
Der Schlüsselunterschied zwischen molekularer Bewegung und Diffusion ist, dass die Molekulare Bewegung ist die Bewegung von Molekülen in einer Substanz ohne einen äußeren Einfluss, während die Diffusion die Bewegung von Molekülen aus einem Bereich mit hoher Konzentration in einen Bereich der niedrigeren Konzentration ist.
Molekulare Bewegung und Diffusion sind als Erklärungen für das Verhalten von Substanzenmolekülen sehr wichtig. Alle Materie enthält Partikel; Atome, Ionen oder Moleküle. In den meisten Fällen können wir Moleküle anstelle von Atomen oder Ionen finden, weil Moleküle stabiler sind. Darüber hinaus befinden sich alle Formen von Materie immer in einem von drei Materiezuständen; Gas, Flüssigkeit oder Feststoffzustand. Die Bewegung der Moleküle in diesen drei Zuständen wird durch molekulare Bewegung und Diffusion beschrieben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist molekulare Bewegung
3. Was ist Diffusion
4. Seite für Seitenvergleich - Molekulare Bewegung gegen Diffusion in tabellarischer Form
5. Zusammenfassung
Was ist molekulare Bewegung?
Molekulare Bewegung ist die Bewegung von Molekülen in einer Substanz ohne externen Einfluss. Dies bedeutet, dass es die Bewegung von Partikeln in einer Substanz hier und da zufällig ist. Diese Bewegung tritt nur innerhalb der Grenze der Substanz auf. Diese Bewegungen verursachen molekulare Kollisionen, bei denen Moleküle miteinander kolloid sind. Diese Kollisionen verursachen das Aufprall von Molekülen.
Da die Moleküle eines Feststoffs gut gepackt sind, sind die molekularen Bewegungen bei den Feststoffen sehr begrenzt. In Flüssigkeiten gibt es im Vergleich zu Festkörpern mehr Bewegungen und Kollisionen. In Gasen haben Moleküle einen großen Raum für molekulare Bewegungen und es gibt auch einen hohen Kollisionsgrad. Wenn wir einen externen Einfluss auf eine Substanz verwenden, ändern sich die Bewegungen entsprechend. Beispiel: Wenn wir die Temperatur eines Gases erhöhen, steigt die Bewegungsgeschwindigkeit, sodass auch die Kollisionen hoch sind.
Was ist Diffusion?
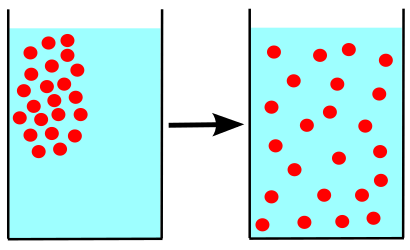
Die Diffusion ist die Bewegung von Molekülen aus einem Bereich mit hoher Konzentration zu einer geringen Konzentration über einen Konzentrationsgradienten. Diese Bewegungen treten in derselben Lösung auf. Die Faktoren, die den Konzentrationsgradienten beeinflussen.

Abbildung 01: Diffusion in einem einfachen Diagramm
Diese Bewegung endet, wenn die Konzentrationen der beiden Regionen an jedem Punkt gleich werden. Dies bedeutet, dass diese Bewegung auftritt, bis der Konzentrationsgradient verschwindet. Dann breiten sich die Moleküle überall in der Lösung aus.
Was ist der Unterschied zwischen molekularer Bewegung und Diffusion?
Molekulare Bewegung ist die Bewegung von Molekülen in einer Substanz ohne externen Einfluss. Es ist eine zufällige Bewegung. Darüber hinaus können externe Faktoren diese Bewegung beeinflussen, ich.e. Temperatur und Druck. Die Diffusion ist die Bewegung von Molekülen aus einem Bereich mit hoher Konzentration zu einer geringen Konzentration über einen Konzentrationsgradienten. Daher ist es keine zufällige Bewegung. Die Faktoren, die den Konzentrationsgradienten beeinflussen, beeinflusst die Bewegung von Molekülen. Dies ist der Hauptunterschied zwischen molekularer Bewegung und Diffusion.
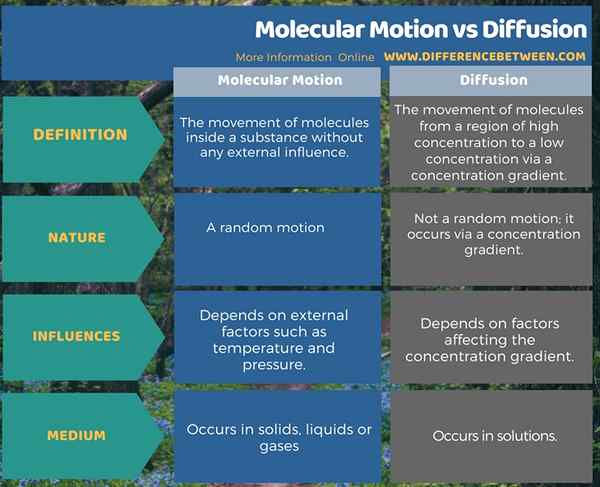
Zusammenfassung -Molekulare Bewegung gegen Diffusion
Molekulare Bewegungen und Diffusion sind sehr wichtig, um das Verhalten von Partikeln in Substanzen zu erklären. Der Unterschied zwischen molekularer Bewegung und Diffusion besteht darin.
Referenz:
1. „Bewegung von Molekülen (Klassen 6-8).”NYU. Hier verfügbar
2. "Diffusion.Wikipedia, Wikimedia Foundation, 27. Juni 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Diffusion' durch JRPOL - eigene Arbeit (CC von 3.0) über Commons Wikimedia


