Unterschied zwischen molekularer Orbitalentheorie und Hybridisierungstheorie
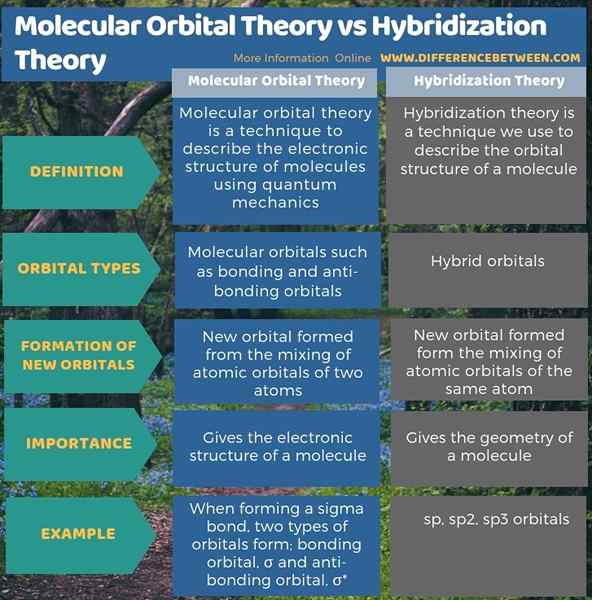
Der Schlüsselunterschied Zwischen der molekularen Orbitalentheorie und der Hybridisierungstheorie ist das, dass Die molekulare Orbitalentheorie beschreibt die Bildung von Bindungs- und Anti-Bindungsorbitalen, während die Hybridisierungstheorie die Bildung von Hybridorbitalen beschreibt.
Es werden verschiedene Theorien entwickelt, um die elektronischen und orbitalen Strukturen von Molekülen zu bestimmen. VSEPR -Theorie, Lewis -Theorie, Valenzbindungstheorie, Hybridisierungstheorie und molekulare Orbitalentheorie sind solche wichtigen Theorien. Die akzeptabelste Theorie unter ihnen ist die molekulare Orbitalentheorie.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist molekulare Orbitalentheorie
3. Was ist die Hybridisierungstheorie
4. Seite an Seitenvergleich - Molekulare Orbitalentheorie gegen Hybridisierungstheorie
5. Zusammenfassung
Was ist molekulare Orbitalentheorie?
Die molekulare Orbitalentheorie ist eine Technik zur Beschreibung der elektronischen Struktur von Molekülen unter Verwendung der Quantenmechanik. Es ist die produktivste Art, die chemische Bindung in Molekülen zu erklären. Lassen Sie uns diese Theorie im Detail diskutieren.
Zunächst müssen wir wissen, welche molekularen Orbitale sind. Eine chemische Bindung bildet sich zwischen zwei Atomen, wenn die Netto -attraktiv. Grundsätzlich bedeutet dies, dass die attraktiven Kräfte zwischen zwei Atomen höher sein sollten als die abstoßenden Kräfte zwischen diesen beiden Atomen. Hier müssen die Elektronen in einer Region namens „Bindungsregion“ existieren, um diese chemische Bindung zu bilden. Wenn nicht, befinden sich die Elektronen in der „Anti-Bindungsregion“, die der abstoßenden Kraft zwischen den Atomen hilft.
Wenn die Anforderungen jedoch erfüllt sind und eine chemische Bindungsbindung zwischen zwei Atomen bildet, werden die entsprechenden Orbitale, die an der Bindung beteiligt sind. Hier können wir mit zwei Orbitalen von zwei Atomen beginnen und ein Orbital (das molekulare Orbital) haben, das zu beiden Atomen gehört.
Nach Quantenmechanik können Atomorbitale nicht erscheinen oder verschwinden, wie wir es wünschen. Wenn Orbitale miteinander interagieren, neigen sie dazu, ihre Formen entsprechend zu ändern. Laut Quantenmechanik können sie jedoch die Form ändern, müssen jedoch die gleiche Anzahl von Orbitalen haben. Dann müssen wir das fehlende Orbital finden. Hier macht die In-Phasen-Kombination der beiden atomaren Orbitale das Bindungsorbital, während die Kombination außerhalb der Phase das Anti-Bonding-Orbital bildet.
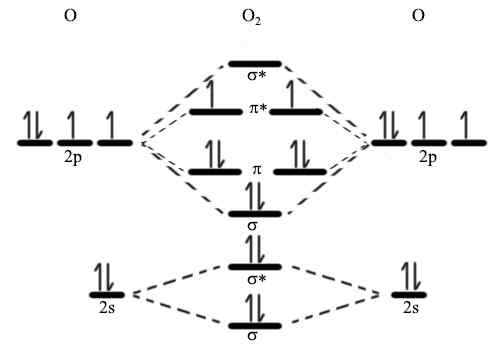
Abbildung 01: Molekular Orbital -Diagramm
Die Bindungselektronen belegen das Bindungsorbital, während die Elektronen im Anti-Bindungs-Orbital nicht an der Bildung von Bindungen beteiligt sind. Vielmehr lehnen diese Elektronen aktiv die Bildung der chemischen Bindung ab. Das Bindungsorbital hat eine geringere potentielle Energie als das Anti-Bonding-Orbital. Wenn wir eine Sigma-Bindung betrachten, beträgt die Bezeichnung für das Binden von Orbital σ und das Anti-Bindungs-Orbital σ*. Wir können diese Theorie verwenden, um die Struktur komplizierter Moleküle zu beschreiben, um zu erklären, warum einige Moleküle nicht existieren (i.e. Er2) und die Bindungsreihenfolge von Molekülen. Somit erklärt diese Beschreibung kurz die Grundlage der molekularen Orbitalentheorie.
Was ist die Hybridisierungstheorie?
Die Hybridisierungstheorie ist eine Technik, mit der wir die Orbitalstruktur eines Moleküls beschreiben. Hybridisierung ist die Bildung von Hybridorbitalen durch Mischen von zwei oder mehr Atomorbitalen. Die Ausrichtung dieser Orbitale bestimmt die Geometrie des Moleküls. Es ist eine Expansion der Valenz -Bond -Theorie.
Vor der Bildung der atomaren Orbitale haben sie unterschiedliche Energien, aber nach der Bildung haben alle Orbitale die gleiche Energie. Zum Beispiel kann ein S -Atom -Orbital und ein P -Atom -Orbital zu zwei SP -Orbitalen bilden. Die S- und P -Atomorbitale haben unterschiedliche Energien (Energie von s < energy of p). But after the hybridization, it forms two sp orbitals which have the same energy, and this energy lies between the energies of individual s and p atomic orbital energies. Moreover, this sp hybrid orbital has 50% s orbital characteristics and 50% p orbital characteristics.

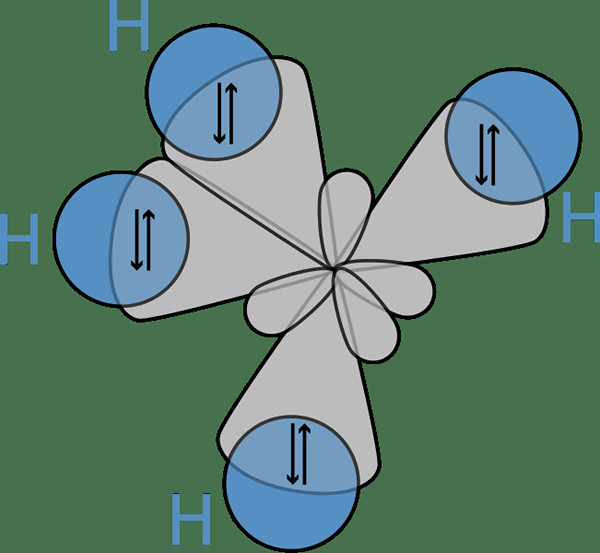
Abbildung 02: Bindung zwischen Hybridorbitalen eines Kohlenstoffatoms und S -Orbitalen von Wasserstoffatomen
Die Idee der Hybridisierung hat zuerst die Diskussion eingetragen4. Obwohl das Kohlenstoffatom nach seiner Elektronenkonfiguration nur zwei ungepaarte Elektronen hat, kann es vier kovalente Bindungen bilden. Um vier Bindungen zu bilden, müssen vier ungepaarte Elektronen vorhanden sein.
Die einzige Möglichkeit, dieses Phänomen zu erklären, bestand darin, zu glauben, dass S- und P -Orbitale von Kohlenstoffatom miteinander verschmelzen, um neue Orbitale zu bilden, die als Hybridorbitale bezeichnet werden und die gleiche Energie haben. Hier gibt ein S + drei p 4 sp3 Orbitale. Daher füllen die Elektronen diese hybriden Orbitale gleichmäßig (ein Elektron pro hybridem Orbital) und folgen der Hunder -Regel. Dann gibt es vier Elektronen zur Bildung von vier kovalenten Bindungen mit vier Wasserstoffatomen.
Was ist der Unterschied zwischen der molekularen Orbitalentheorie und der Hybridisierungstheorie?
Die molekulare Orbitalentheorie ist eine Technik zur Beschreibung der elektronischen Struktur von Molekülen unter Verwendung der Quantenmechanik. Die Hybridisierungstheorie ist eine Technik, mit der wir die Orbitalstruktur eines Moleküls beschreiben. Der Schlüsselunterschied zwischen der molekularen Orbitalentheorie und der Hybridisierungstheorie besteht darin.
Nach der molekularen Orbitalentheorie Formen aus der Mischung von Atomorbitalen von zwei Atomen in der Hybridisierungstheorie bilden nach der Mischung von Atomformen von neuen Orbital die Mischung von atomaren Orbitalen desselben Atoms. Daher ist dies ein weiterer Unterschied zwischen der molekularen Orbitalentheorie und der Hybridisierungstheorie.
Zusammenfassung -Molekulare Orbitalentheorie gegen Hybridisierungstheorie
Sowohl die molekulare Orbitalentheorie als auch die Hybridisierungstheorie sind wichtig für die Bestimmung der Struktur eines Moleküls. Der Schlüsselunterschied zwischen der molekularen Orbitalentheorie und der Hybridisierungstheorie besteht darin, dass die molekulare Orbitalentheorie die Bildung von Bindung und Anti-Bindungsorbitalen beschreibt, während die Hybridisierungstheorie die Bildung von Hybridorbitalen beschreibt.
Referenz:
1. „Hybridisierung.”Chemistry Libretexten, Libretexte, 5. Juni 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "O2Moleculardiagramcr" von TCReuter - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "CH4 Hybridisierung" von k. Aainsqatsi bei englischer Wikipedia (Originaltext: K. Aainsqatsi) - eigene Arbeit (Originaltext: selbstgemacht) (öffentlich zugänglich) über Commons Wikimedia


