Unterschied zwischen molekularer Orbitalentheorie und Valenzbindungstheorie
Der Schlüsselunterschied Zwischen der Theorie der molekularen Orbitalentheorie und der Valenzbindung ist das, dass Die molekulare Orbitalentheorie beschreibt die molekulare Orbitalbildung, während die Valenzbindungstheorie die Atomorbitale beschreibt.
Unterschiedliche Moleküle haben unterschiedliche chemische und physikalische Eigenschaften als einzelne Atome, die diese Moleküle bildeten. Um diese Unterschiede zwischen atomaren und molekularen Eigenschaften zu verstehen, ist es notwendig, die Bildung chemischer Bindungen zwischen mehreren Atomen zu verstehen, um ein Molekül zu erstellen. Gegenwärtig verwenden wir zwei quantenmechanische Theorien, um die kovalente Bindung und elektronische Struktur von Molekülen zu beschreiben. Dies sind Valenzbindungstheorie und molekulare Orbitalentheorie.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist molekulare Orbitalentheorie
3. Was ist Valenz -Bond -Theorie
4. Seite für Nebenvergleich - Theorie der Molekulare Orbital -Theorie gegen Valenzbindung in tabellarischer Form
5. Zusammenfassung
Was ist molekulare Orbitalentheorie?
In Molekülen befinden sich Elektronen in molekularen Orbitalen, aber ihre Formen sind unterschiedlich und sie sind mit mehr als einer Atomkerne assoziiert. Die molekulare Orbitalentheorie ist die Beschreibung von Molekülen basierend auf molekularen Orbitalen.
Wir können die Wellenfunktion erhalten, die ein molekulares Orbital durch die lineare Kombination von Atomorbitalen beschreibt. Ein Bindungsorbital bildet sich, wenn zwei Atomorbitale in derselben Phase interagieren (konstruktive Wechselwirkung). Wenn sie aus der Phase interagieren (zerstörerische Wechselwirkung), anti-dichtende Orbitale aus. Daher gibt es für jede suborbitale Wechselwirkung Bindungs- und Anti-Bindungsorbitale. Bindungsorbitale haben eine geringe Energie, und Elektronen leben eher in diesen. Anti-Bindungsorbitale sind energie groß, und wenn alle Bindungsorbitale gefüllt sind, gehen die Elektronen die Anti-Bonding-Orbitale aus.
Was ist Valenz -Bond -Theorie?
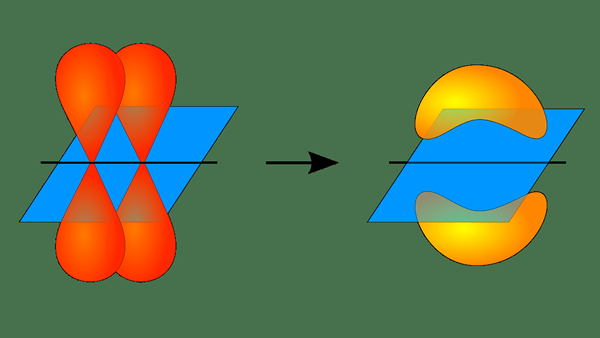
Die Valenz -Bond -Theorie basiert auf einem lokalisierten Bond -Ansatz, der davon ausgeht. Zum Beispiel in der Bildung des h2 Molekül, zwei Wasserstoffatome überlappen ihre 1S -Orbitale. Durch die Überlappung der beiden Orbitale teilen sie eine gemeinsame Region im Raum. Wenn die beiden Atome weit voneinander entfernt sind, gibt es zunächst keine Wechselwirkung zwischen ihnen. Daher ist die potentielle Energie Null.
Wenn sich die Atome aufeinander nähern, wird jedes Elektron vom Kern im anderen Atom angezogen und gleichzeitig die Elektronen gegenseitig abweichen, ebenso wie die Kerne. Während die Atome noch getrennt sind, ist die Anziehungskraft größer als die Abstoßung, so dass die potentielle Energie des Systems abnimmt. Der Punkt, an dem die potentielle Energie den Mindestwert erreicht, ist das System in der Stabilität. Dies passiert, wenn zwei Wasserstoffatome zusammenkommen und das Molekül bilden.

Abbildung 01: Bildung einer PI -Bindung
Dieses überlappende Konzept kann jedoch nur einfache Moleküle wie H beschreiben2, F2, HF usw. Diese Theorie erklärt Moleküle wie CH nicht4. Trotzdem kann dieses Problem gelöst werden, indem diese Theorie mit der hybriden Orbitalentheorie kombiniert wird. Hybridisierung ist die Vermischung von zwei nicht jeds Äquivalent atomaren Orbitalen. Zum Beispiel in CH4, C hat vier hybridisierte sp3 Orbitale überlappen sich mit den S -Orbitalen jedes h.
Was ist der Unterschied zwischen der molekularen Orbitalentheorie und der Valenzbindungstheorie?
Gegenwärtig verwenden wir zwei quantenmechanische Theorien, um die kovalente Bindung und elektronische Struktur von Molekülen zu beschreiben. Dies sind Valenzbindungstheorie und molekulare Orbitalentheorie. Der Schlüsselunterschied zwischen der Theorie der molekularen Orbitalentheorie und der Valenzbindung besteht darin, dass die molekulare Orbitalentheorie die molekulare Orbitalbildung beschreibt, während die Valenzbindungstheorie die Atomorbitale beschreibt. Darüber hinaus kann die Valenzbindungstheorie nur für zweiatomische Moleküle angewendet werden. Wir können jedoch die molekulare Orbitalentheorie für jedes Molekül anwenden.
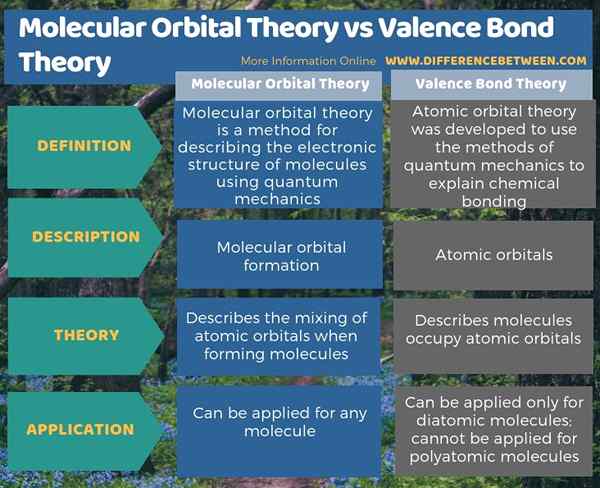
Zusammenfassung -Theorie der Molekulare Orbitalentheorie gegen Valenzbindung
Valenzbindungstheorie und molekulare Orbitalentheorie sind die beiden quantenmechanischen Theorien, die die kovalente Bindung und die elektronische Struktur von Molekülen beschreiben. Der Schlüsselunterschied zwischen der Theorie der molekularen Orbitalentheorie und der Valenzbindung besteht darin, dass die molekulare Orbitalentheorie die molekulare Orbitalbildung beschreibt, während die Valenzbindungstheorie die Atomorbitale beschreibt.
Referenz:
1. Helmenstine, Anne Marie. „Valence Bond (VB) Theoriedefinition.”Thoughtco, August. 4, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Pi-Bond" von Pi-Bond.JPG: Jojanderivative Arbeit: Vladsinger (Talk) - Pi -Bond.JPG (CC BY-SA 3.0) über Commons Wikimedia


