Unterschied zwischen molekularem solidem und kovalentem Netzwerk solide
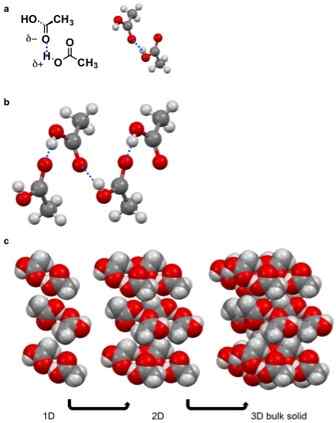
Der Schlüsselunterschied zwischen molekularem festem und kovalentem Netzwerk solide ist das Molekulare Festkörperformen aufgrund der Wirkung von Van der Waal -Kräften, während kovalente Netzwerk -Feststoffformen aufgrund der Wirkung kovalenter chemischer Bindungen.
Wir können feste Verbindungen auf unterschiedliche Weise kategorisieren - abhängig von der Struktur, Zusammensetzung, Bindung, Eigenschaften, Anwendungen usw. Molekulare Feststoffe, ionische Feststoffe, metallische Feststoffe, kovalente Netzwerkfeststoffe sind so unterschiedliche Arten von Festkörpern.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist molekular fest
3. Was ist kovalentes Netzwerk solide
4. Seite an Seitenvergleich - molekularer Feststoff gegen kovalentes Netzwerk fest in tabellarischer Form
5. Zusammenfassung
Was ist molekular fest?
Ein molekularer Feststoff ist eine feste Verbindung, die Moleküle enthält, die über Van der Waal -Kräfte zusammengehalten werden. Es gibt keine ionischen oder kovalenten Bindungen zwischen diesen Molekülen. Die Kräfte zwischen diesen Molekülen sind kohärente Anziehungskräfte. Es gibt verschiedene Arten von Van der Waal -Kräfte, die die Bildung eines molekularen Feststoffs verursachen können, i.e. Dipol-Dipol-Wechselwirkungen, PI-PI-Wechselwirkungen, Wasserstoffbindung, Londoner Streitkräfte usw.

Abbildung 01: Bildung von molekularen Feststoffen aufgrund der Wasserstoffbrückenbindung
Diese Van der Waal -Kräfte sind jedoch schwächer als ionische und kovalente chemische Bindungen. Daher haben molekulare Feststoffe typischerweise relativ geringe Schmelz- und Siedepunkte. Darüber hinaus neigen diese Feststoffe dazu, sich in organischen Lösungsmitteln aufzulösen. Diese molekularen Feststoffe haben eine niedrige Dichte und sind auch nicht leitend; Dies sind also weiche elektrische Isolatoren.

Abbildung 02: Festes Kohlendioxid und festes Koffein sind molekulare Feststoffe
Darüber hinaus existieren alle Allotrope, wenn sie die verschiedenen Allotrope eines chemischen Elements betrachten, manchmal als molekulare Festkörper. Zum Beispiel gibt es verschiedene allotrope Formen von Phosphor; Wir nennen sie als rote, weiße und schwarze Phosphor. Unter ihnen ist weiße Phosphor ein molekularer fester, aber rote Phosphor existiert als Kettenstrukturen.
Darüber hinaus sind molekulare Feststoffe je nach Art der Kristallflächen des Feststoffs entweder duktil oder spröde. Sowohl diese diese duktile als auch spröde Formen können sich auch einer elastischen Verformung durchführen.
Was ist ein kovalentes Netzwerk solide?
Kovalente Netzwerkfeststoffe sind feste Verbindungen, die über kovalente chemische Bindungen mit Atomen enthalten sind. Diese Feststoffe haben eine Reihe von wiederholenden Atomen, die über kovalente Bindungen miteinander verbunden sind. Die chemische Bindung kann die Bildung eines Netznetzes von Atomen verursachen, was zur Bildung eines Netzwerks führt. Daher können wir einen kovalenten Netzwerk solide als eine Art von Makromolekül betrachten.
Darüber hinaus können diese Feststoffe auf zwei Arten auftreten; als kristalline Feststoff oder amorphe Feststoffe. Ein geeignetes Beispiel für einen Netzwerk -Feststoff ist Diamant mit kovalent gebundenen Kohlenstoffatomen, das eine starke 3D -Struktur bildet. Normalerweise haben kovalente Netzwerkfeststoffe relativ hohe Schmelz- und Siedepunkte. Im Allgemeinen sind diese Feststoffe in jeder Art von Lösungsmittel unlöslich, da es sehr schwierig ist, die Bindungen zwischen Atomen zu brechen. Darüber hinaus sind diese Feststoffe sehr hart und haben eine niedrige elektrische Leitfähigkeit in seiner flüssigen Phase. Die elektrische Leitfähigkeit in der festen Phase kann je nach Zusammensetzung variieren.
Was ist der Unterschied zwischen molekularem fester und kovalenter Netzwerk -Feststoff?
Molekulare Feststoffe und kovalente Netzwerkfeststoffe sind zwei Arten von Feststoffverbindungen. Der Schlüsselunterschied zwischen molekularem Feststoff und kovalenter Netzwerk -Feststoff besteht darin. Bei der Betrachtung ihrer Eigenschaften sind molekulare Feststoffe relativ weiches Material, während kovalente Netzwerkfeststoffe sehr hart sind.
Darüber hinaus haben molekulare Feststoffe relativ niedrige Schmelzpunkte, während kovalente Netzwerkfeststoffe sehr hohe Schmelzpunkte haben. Darüber hinaus sind molekulare Feststoffe elektrische Isolatoren, während kovalente Netzwerkfeststoffe im flüssigen Zustand eine geringe elektrische Leitfähigkeit aufweisen und die elektrische Leitfähigkeit in fester Phase je nach Zusammensetzung variieren kann. Wassereis ist ein gutes Beispiel für molekulare Feststoffe, während Diamond das beste Beispiel für einen kovalenten Netzwerk ist.
Die folgende Infografik fasst den Unterschied zwischen molekularem solidem und kovalentem Netzwerk fest,.
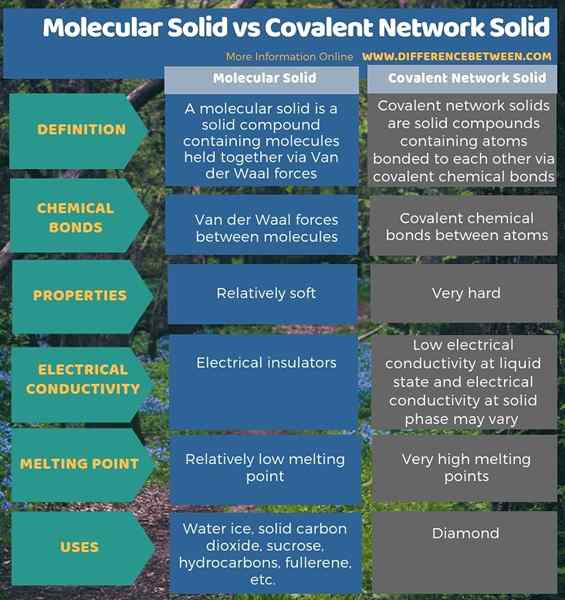
Zusammenfassung -molekularer Feststoff gegen kovalentes Netzwerk solide
Molekulare Feststoffe und kovalente Netzwerkfeststoffe sind zwei Arten von Feststoffverbindungen. Der Schlüsselunterschied zwischen molekularem Feststoff und kovalenter Netzwerk -Feststoff besteht darin.
Referenz:
1. Helmenstine, Anne Marie. „Molekulare Feststoffe: Definition und Beispiele.”Thoughtco, dec. 3, 2018, hier erhältlich.
2. Helmenstine, Anne Marie. „Network Solid Definition in der Chemie.”Thoughtco, Jul. 8, 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. „Essigsäure -Wasserstoffbrückenbindung“ durch Cryst Eng 340 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Kohlendioxid und Koffein" von Cryst Eng 340 - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia


