Unterschied zwischen monatomisch und polyatomisch
Monatomisch gegen polyatomar
Die Anzahl der in einem bestimmten Ion oder einem Molekül vorhandenen Atome trägt zum Unterschied zwischen monatomisch und polyatomisch bei. Die beiden Wörter „Mono“ und „Poly“ geben die allgemeine Vorstellung vom Molekül; "Mono" bedeutet "Single" und "Poly" bedeutet "viele".”Monatomisch bezieht sich auf die Ionen oder Moleküle mit einem einzigen Atom. Polyatomisch bezieht sich auf die Moleküle oder Ionen mit zwei oder mehr Atomen. Es gibt so viele physikalische und chemische Unterschiede zwischen monatomisch und Polyatomar. Im Allgemeinen sind monatomische chemische Elemente im Vergleich zur Existenz von polyatomischen Molekülen weniger häufig.
Was ist monatomisch?
Das Wort monatomisch leitet sich aus zwei Wörtern "mono" und "atomic" ab und gibt die Bedeutung von "Single Atom.”Monatomische chemische Spezies enthalten nur ein Atom und sie sind stabil, auch wenn sie allein existieren. Dies kann auf Gase und Ionen angewendet werden. Die meisten edlen Gase existieren als monatomische chemische Spezies.
Monatomionen: Diese Ionen werden gebildet, indem (positive Ionen) oder Gewinne (negative Ionen) Elektronen verloren gehen.
Positive Ionen: N / A+, K+, Ca2+, Al3+
Negative Ionen: Cl-, S2-, Br-, F-
Monatomische Moleküle: Edelgase fallen in diese Kategorie und sie sind sehr stabil; Daher chemisch inaktiv.

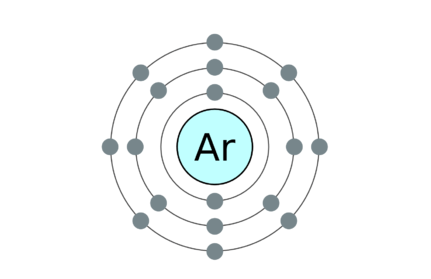
18: Argon 2, 8, 8
Was ist polyatomisch?
Das Wort Polyatomic stammt aus zwei Wörtern "Poly" und "Atomic", bedeutet viele Atome. Es kann homogene Atome sein (o2, Hg22+, Ö3, Ö22-) oder eine Kombination von heterogenen Atomen (CN-, H2SO4, Clo3-). Die meisten Moleküle und Ionen existieren als polyatomische Natur.
Polyatomionen: "Molekülionen" ist ein anderer Name für polyatomische Ionen. Die meisten polyatomischen Ionen sind entweder kovalent gebundene chemische Spezies oder metallische Komplexe.
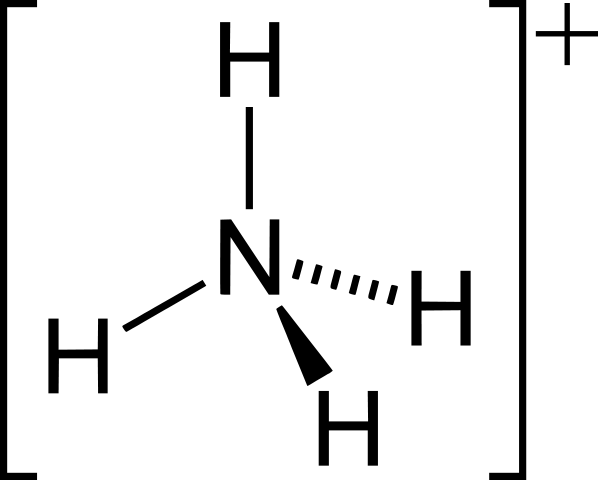
Positive Ionen: NH4+, H3Ö+, PH4+
Negative Ionen: Cro42-, CO32-, CH3GURREN-, SO42-, NEIN3-
Polyatomische Moleküle: Sie sind die Moleküle mit zwei oder mehr Atomen. Sie haben keine positive oder negative Ladung. Mit anderen Worten, diese Moleküle sind elektrisch neutral. (H2SO4, CH3COOH, NA2CO3, NaCl, c2H4)
Ammonium
Was ist der Unterschied zwischen monatomisch und polyatomisch?
• Anzahl der Atome:
• Monatomische chemische Elemente enthalten Nur ein Atom.
• Polyatomische chemische Verbindungen haben Zwei oder mehr Atome.
• Zustand:
• Monatomische chemische Spezies können Ionen oder inerte Gase sein.
• Einige Polyatomspezies sind Ionen und einige sind Moleküle.
• Eigenschaften
• Die meisten monatomischen Ionen sind in Wasser stabil.
• Monatomische Moleküle sind sehr stabil; Daher chemisch inaktiv.
• Die meisten polyatomischen Ionen sind entweder kovalent gebunden oder metallische Komplexe.
• Polyatomische Moleküle sind elektrisch neutral.
• Beispiele für monatomisch und polyatomar:
• Beispiele für Monatomionen sind na+, Ca2+, K+, Al3+ und Fe3+.
• Beispiele für monatomische Moleküle sind edle Gase. Sie sind Helium (er), Neon (NE), Argon (AR), Krypton (KR), Xenon (XE) und Radon (RA).
• Beispiele für Polyatomionen sind cro42-, CO32-, NH4+, H3Ö+.
• Beispiele für Polyatomische Moleküle sind kcl, kbro3, C6H5Cooh.
• Größe:
• Die Größe der monatomischen chemischen Spezies unterscheidet sich je nach Art und Weise, wie sie sich bilden. Wenn beispielsweise positive Ionen gebildet werden, nimmt ihre Größen ab und wenn negative Ionen gebildet werden, steigt die Größe als das ursprüngliche Atom. Edelgase haben die geringste Größe im Vergleich zu den anderen Elementen in ihrer Periode im Periodenzüchter.
• Wenn polyatomische chemische Verbindungen gebildet werden, wird die Größe des polyatomischen Ions oder des polyatomischen Molekül. Weil zwei oder mehr Atome zu einem polyatomischen Ion /Molekül bilden.
• Form:
• Im Allgemeinen sind monatomische Moleküle und Ionen in ihrer Geometrie sphärisch.
• Die Geometrie der polyatomischen chemischen Spezies variiert je nach Anzahl der Moleküle und der einsamen Paare im Molekül. Wenn die Anzahl der Atome zunimmt, werden komplexere Strukturen gebildet, um Stabilität zu erreichen.
Bilder mit freundlicher Genehmigung:
- Argon von Greg Robson (CC BY-SA 2.0 uk)
- Ammonium über Wikicommons (Public Domain)


