Unterschied zwischen N2 und 2n
Der Schlüsselunterschied Zwischen N2 und 2n ist das N2 ist molekularer Stickstoff- oder Stickstoffgas, während 2n einfach auf zwei Stickstoffatome bezieht.
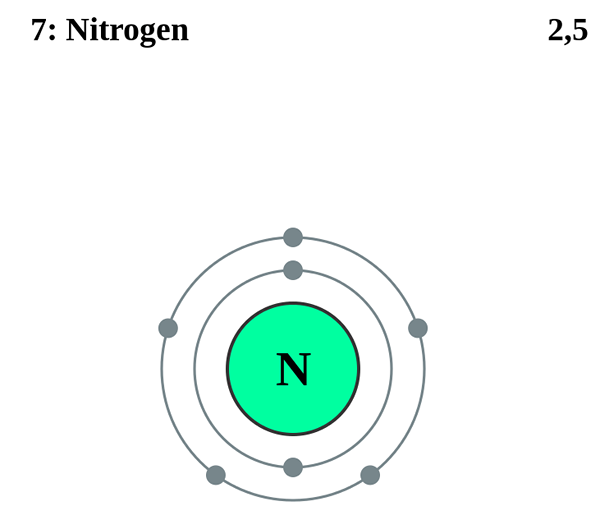
Stickstoff ist ein chemisches Element, und wir können es in Gruppe 15 und Periode 2 der Periodenzüchter chemischer Elemente finden. Es tritt in der Natur als Stickstoffgas auf.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist N2
3. Was ist 2n
4. Seite an Seitenvergleich - N2 gegen 2n in tabellarischer Form
5. Zusammenfassung
Was ist N2?
N2 ist molekularer Stickstoff oder Stickstoffgas. Es ist ein zweidomisches Molekül mit einer extrem starken Dreifachbindung im elementaren Stickstoff. Es ist die zweitstärkste Bindung in jedem zweizomischen Molekül, der nur zur Bindung im Kohlenmonoxid ist. Daher ist es sehr schwierig, N2 sowohl für Organismen als auch für Branchen in nützliche stickstoffhaltige Verbindungen umzuwandeln. Gleichzeitig setzt das Verbrennen, Explosion oder Zersetzung dieser dreifachen Bindung im Stickstoffmolekül eine große Menge nützlicher Energie frei.

Im Allgemeinen ist Stickstoffgas farblos, geruchlos und geschmacklos. Es ist ein diamagnetisches Gas und kann bei sehr niedrigen Temperaturen schmelzen (ca. -210 Celsius Grad). N2 -Molekül ist bei Raumtemperatur nicht reaktiv, kann aber mit Lithiummetall und einigen anderen Übergangsmetallkomplexen reagieren. Darüber hinaus kann N2 mit einer Temperatur von etwa 77 k verflüssigt werden und kann bei 63 k einfrieren. Dieses Gefrierpunkt bildet hexagonal-close-gepackte, kristallalotrope Form.
Was ist 2n?
2n bezieht sich einfach auf zwei Stickstoffatome. Wenn sich zwei Stickstoffatome miteinander verbinden, führt dies zu einem diatomischen Stickstoffmolekül, das natürlich vorkommende Form von Stickstoffgas ist. Ein Stickstoffatom hat sieben Elektronen in der elektronischen Konfiguration 1s22s22p3. Daher gibt es fünf Valenzelektronen in einem Atom Stickstoff (in den 2S- und 2p -Orbitalen). Unter diesen fünf Valenzelektronen sind drei ungepaart und die anderen beiden werden miteinander kombiniert.
Darüber hinaus hat ein Stickstoffatom einen der höchsten Elektronegativitätswerte zwischen chemischen Elementen (der Wert wird nur durch die Elektronegativitätswerte von Chlor, Sauerstoff und Fluor übertroffen). Aufgrund dieser hohen Zahl hat Stickstoff normalerweise keine kationische Chemie. Normalerweise ähneln Stickstoffatome aufgrund ihrer hohen Elektronegativität und gleichzeitigen Fähigkeit zur Wasserstoffbrückenbindung Sauerstoffatomen. Darüber hinaus können Sie Koordinationskomplexe bilden, die dem von Sauerstoff ähnlich sind, indem Sie die einsamen Elektronenpaare spenden.
Darüber hinaus kann der Begriff 2n auf jedes stabile Isotop von Stickstoff verweisen, da es zwei stabile Isotope Stickstoff gibt, einschließlich N-14 und N-15. Unter ihnen ist das häufigste Isotop N-14, was etwa 99% des natürlichen Stickstoffgehalts ausmacht.
Darüber hinaus können 2n oder zwei Stickstoffatome aufgrund der hohen Reaktivität als aktiver Stickstoff bezeichnet werden, und das freie Stickstoffatom ist ein Tri-Radikal mit drei ungepaarten Elektronen. Daher können diese freien Stickstoffatome leicht mit anderen chemischen Elementen zu Nitriden reagieren, und wenn zwei Stickstoffatome miteinander reagieren, um ein angeregtes N2 -Molekül zu bilden.
Was ist der Unterschied zwischen N2 und 2n?
N2 und 2n sind zwei Formen des chemischen Stickstoff -Elements. Der Schlüsselunterschied zwischen N2 und 2N besteht darin. Daher ist N2 ein Diatomgasmolekül, während 2n ein freies Stickstoffatom ist. Darüber hinaus ist N2 größtenteils inert, während 2n hochreaktiv ist.
Unten finden Sie eine Zusammenfassung des Unterschieds zwischen N2 und 2n in tabellarischer Form.

Zusammenfassung -N2 vs 2n
Stickstoff ist ein wichtiges chemisches Element. Der Schlüsselunterschied zwischen N2 und 2N besteht darin.
Referenz:
1. "Stickstoff.” Wikipedia, Wikimedia Foundation, 23. Februar. 2021, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. „Elektronenschale 007 Stickstoff“ von Pumbaa (Originalarbeit von Greg Robson) - Datei: Elektronenschale 007 Stickstoff.PNG (CC BY-SA 2).0 uk) über Commons Wikimedia


