Unterschied zwischen Nernst -Gleichung und Goldman -Gleichung
Der Schlüsselunterschied Zwischen der Nernst -Gleichung und der Goldman -Gleichung ist das Die Nernst -Gleichung beschreibt die Beziehung zwischen dem Reduktionspotential und dem Standard -Elektrodenpotential, während Goldman -Gleichung eine Derivat der Nernst -Gleichung ist und das Umkehrpotential über eine Zellmembran über beschreibt.
Eine elektrochemische Zelle ist ein elektrisches Gerät, das mithilfe der chemischen Energie chemischer Reaktionen Elektrizität erzeugen kann. Oder wir können diese Geräte verwenden, um chemische Reaktionen zu unterstützen, indem wir die erforderliche Energie aus Strom bereitstellen. Das Reduktionspotential einer elektrochemischen Zelle bestimmt die Fähigkeit der Zelle, Elektrizität zu erzeugen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Nernst Gleichung
3. Was ist Goldman -Gleichung
4. Seite an Seitenvergleich - Nernst -Gleichung vs. Goldman -Gleichung in tabellarischer Form
5. Zusammenfassung
Was ist Nernst Gleichung?
Die Nernst -Gleichung ist eine mathematische Expression, die die Beziehung zwischen dem Reduktionspotential und dem Standard -Reduktionspotential einer elektrochemischen Zelle ergibt. Die Gleichung ist nach dem Wissenschaftler Walther Nernst benannt. Und es wurde unter Verwendung der anderen Faktoren entwickelt, die die elektrochemischen Oxidations- und Reduktionsreaktionen wie Temperatur und chemische Aktivität chemischer Spezies, die oxidiert und reduziert werden.

Bei der Ableitung der Nernst -Gleichung müssen wir die Standardänderungen der Gibbs -freien Energie berücksichtigen, die mit elektrochemischen Transformationen in der Zelle verbunden sind. Die Reduktionsreaktion einer elektrochemischen Zelle kann wie folgt angegeben werden:
Ox+ z e- ⟶ rot
Nach der Thermodynamik ist die tatsächliche Veränderung der freien Energie der Reaktion,
E = edie Ermäßigung - EOxidation
Gibbs Free Energy (ΔG) hängt jedoch wie folgt mit der E (Potentialdifferenz) zusammen:
Δg = -nfe
Wenn n die Anzahl der Elektronen ist, die beim Fortschreiten zwischen chemischen Spezies zwischen chemischen Spezies übertragen werden, ist F die Faraday -Konstante. Wenn wir die Standardbedingungen berücksichtigen, lautet die Gleichung wie folgt:
ΔG0 = -Nfe0
Wir können die freie Energie der nicht standardmäßigen Bedingungen mit der Gibbs-Energie der Standardbedingungen über die folgende Gleichung in Verbindung bringen.
ΔG = ΔG0 + Rtlnq
Anschließend können wir die obigen Gleichungen in diese Standardgleichung ersetzen, um die Nernst -Gleichung wie folgt zu erhalten:
-nfe = -nfe0 + Rtlnq

Wir können die obige Gleichung jedoch mit den Werten für Faraday Constant und R (Universal Gas Constant) umschreiben.
E = e0 - (0.0592vlnq/n)
Was ist Goldman -Gleichung?
Goldman -Gleichung ist nützlich, um das umgekehrte Potential in einer Zellmembran in der Zellmembranphysiologie zu bestimmen. Diese Gleichung wurde nach dem Wissenschaftler David E benannt. Goldman, der die Gleichung entwickelte. Und es wurde aus der Nernst -Gleichung abgeleitet. Goldman -Gleichung berücksichtigt die ungleiche Verteilung von Ionen über die Zellmembran und die Unterschiede in der Membranpermeabilität bei der Bestimmung dieses umgekehrten Potentials. Die Gleichung ist wie folgt:
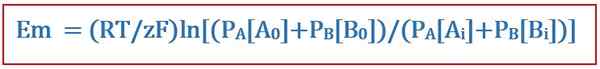
Wo
- EM ist die Potentialdifferenz über die Zellmembran,
- R ist die universelle Gaskonstante,
- T ist die thermodynamische Temperatur,
- Z ist die Anzahl der Mol von Elektronen, die zwischen chemischen Spezies übertragen werden,
- F ist die Faraday -Konstante,
- PA oder B ist die Durchlässigkeit der Membran gegenüber einem oder Bion, und
- [A oder B]ich ist die Konzentration von A oder B -Ion innerhalb der Zellmembran.
Was ist der Unterschied zwischen der Nernst -Gleichung und der Goldman -Gleichung?
Nernst -Gleichung und die Goldman -Gleichung sind mathematische Ausdrücke, die als Messungen des Potentials elektrochemischer Zellen verwendet werden können. Der Schlüsselunterschied zwischen Nernst -Gleichung und Goldman -Gleichung besteht darin, dass die Nernst -Gleichung die Beziehung zwischen dem Reduktionspotential und dem Standard -Elektrodenpotential beschreibt, während die Goldman -Gleichung eine Ableitung der Nernst -Gleichung ist und das Umkehrpotential über eine Zellmembran über eine Zellmembran beschreibt.
Die folgende Infografik fasst den Unterschied zwischen Nernst -Gleichung und Goldman -Gleichung zusammen.

Zusammenfassung -Nernst -Gleichung gegen Goldman -Gleichung
Nernst -Gleichung und die Goldman -Gleichung sind mathematische Ausdrücke, die als Messungen des Potentials elektrochemischer Zellen verwendet werden können. Der Schlüsselunterschied zwischen Nernst -Gleichung und Goldman -Gleichung besteht darin, dass die Nernst -Gleichung die Beziehung zwischen dem Reduktionspotential und dem Standard -Elektrodenpotential beschreibt, aber die Goldman -Gleichung ist ein Derivat der Nernst -Gleichung und beschreibt das Umkehrpotential über eine Zellmembran über eine Zellmembran.
Referenz:
1. „Nernst -Gleichung.”Chemistry Libretexten, Libretexte, 5. Juni 2019, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Electrochemcell" von Alksub bei der englischen Wikipedia (CC BY-SA 3.0) über Commons Wikimedia


