Unterschied zwischen Reaktionsreihenfolge und Molekularität
Schlüsselunterschied - Reaktionsreihenfolge gegen Molekularität
Chemische Reaktionen sind Veränderungen, die in chemischen Verbindungen auftreten. Es führt zur Umwandlung einer chemischen Substanz in eine andere. Die anfänglichen Verbindungen, die sich der chemischen Reaktion unterziehen. Was wir nach Abschluss der Reaktion erhalten, sind Produkte. Reihenfolge der Reaktion wird in Bezug auf eine Substanz angegeben; Es kann in Bezug auf einen Reaktanten, ein Produkt oder einen Katalysator sein. Die Reaktionsreihenfolge in Bezug auf eine Substanz ist der Exponent, auf den seine Konzentration in der Geschwindigkeitsgleichung angehoben wird. Die Molekularität chemischer Reaktionen exprimiert, wie viel Reaktantenmoleküle an der Reaktion beteiligt sind. Der Schlüsselunterschied zwischen der Reaktionsreihenfolge und der Molekularität ist das Die Reaktionsreihenfolge ergibt die Beziehung zwischen der Konzentration einer chemischen Spezies und der Reaktion, die sie unterliegt, während die Molekularität angibt, wie viele reaktante Moleküle an der Reaktion beteiligt sind.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist die Reihenfolge der Reaktion
3. Was ist Molekularität
4. Seite an Seitenvergleich - Reaktionsreihenfolge gegen Molekularität in tabellarischer Form
5. Zusammenfassung
Was ist die Reihenfolge der Reaktion
Die Reaktionsreihenfolge in Bezug auf eine Substanz ist der Exponent, auf den seine Konzentration in der Geschwindigkeitsgleichung angehoben wird. Um dieses Konzept zu verstehen, sollten wir zunächst wissen, welches Ratengesetz ist.
Ratengesetz
Das Geschwindigkeitsgesetz zeigt an, dass die Geschwindigkeit des Fortschreitens einer chemischen Reaktion (bei konstanter Temperatur) proportional zu den Konzentrationen der Reaktanten ist, die zu den Exponenten angehoben werden, die experimentell bestimmt werden. Diese Exponenten werden als Ordnungen dieser Konzentrationen bezeichnet. Betrachten wir ein Beispiel.
2n2Ö5 ↔ 4 Nr2 + Ö2
Für die obige Reaktion ist die Geschwindigkeitsrechtsgleichung wie unten angegeben.
Rate = k.[N2Ö5]X
In der obigen Gleichung ist k die Verhältnismäßigkeitskonstante, die als Geschwindigkeitskonstante bekannt ist. Es ist eine Konstante bei konstanter Temperatur. Die Klammern werden verwendet, um auszudrücken, dass es sich um die Konzentration des Reaktanten handelt. Das Symbol X ist die Reihenfolge der Reaktion in Bezug auf den Reaktanten. Der Wert von x sollte experimentell bestimmt werden. Für diese Reaktion wurde festgestellt, dass x = 1. Hier können wir sehen, dass die Reaktionsreihenfolge nicht gleich der Stöchiometrie der Reaktion ist. Bei einigen Reaktionen kann die Reaktionsreihenfolge jedoch gleich der Stöchiometrie sein.
Für eine Reaktion mit zwei oder mehr Reaktanten, die Ratenrechtsgleichung kann wie unten geschrieben werden.
A+ b+ c ↔ p
Rate = k.[A]A[B]B[C]C
A, B und C sind Befehle der Reaktion in Bezug auf A, B- und C -Reaktanten. Für diese Art von Geschwindigkeitsgleichungen (mit mehreren Reaktionsordnungen) wird die Summe der Reaktionsordnungen als Reaktionsreihenfolge angegeben.
Gesamtreihenfolge = a + b + c

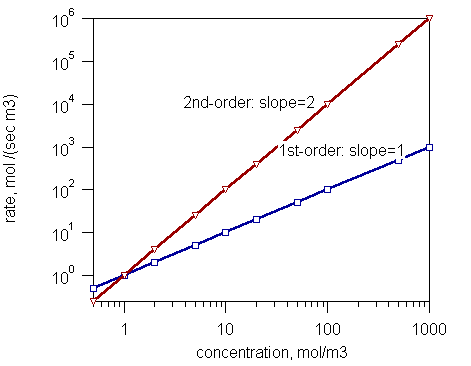
Abbildung 1: Rate der Ersten Ordnung und Reaktionen zweiter Ordnung
Gemäß der Reihenfolge der Reaktion gibt es verschiedene Arten von Reaktionen:
- Reaktionen mit Null Ordnung (Die Reaktionsreihenfolge ist in Bezug auf jeden verwendeten Reaktanten Null. Daher hängt die Reaktionsgeschwindigkeit nicht von den Konzentrationen der verwendeten Reaktanten ab.)
- Reaktionen erster Ordnung (Die Geschwindigkeit ist proportional zur Konzentration eines Reaktanten)
- Reaktionen zweiter Ordnung (Die Reaktionsgeschwindigkeit ist entweder am Quadrat der Konzentration eines Reaktanten oder zum Produkt der Konzentrationen zweier Reaktanten)
Was ist Molekularität
Molekularität einer Reaktion ist die Anzahl der Moleküle oder Ionen, die an einer Reaktion als Reaktanten teilnehmen. Noch wichtiger ist, dass die berücksichtigten Reaktanten diejenigen sind. Der Geschwindigkeitsbestimmungsschritt einer Reaktion ist der langsamste Schritt der Gesamtreaktion. Dies liegt daran, dass der langsamste Reaktionsschritt die Reaktionsgeschwindigkeit bestimmt.
Abbildung 2: eine unimolekulare Reaktion
Die Molekularität kann unterschiedliche Typen sein:
- Unimolekulare Reaktionen haben ein Reaktantmolekül (oder Ion)
- Bimolekulare Reaktionen haben zwei Reaktanten (zwei Reaktanten können dieselbe Verbindung oder verschiedene Verbindungen haben)
- Trimolekulare Reaktionen haben drei Reaktanten.
Was ist der Unterschied zwischen der Reihenfolge der Reaktion und der Molekularität?
Reaktionsreihenfolge gegen Molekularität | |
| Die Reihenfolge der Reaktion in Bezug auf eine Substanz ist der Exponent, auf den ihre Konzentration in der Geschwindigkeitsgleichung angehoben wird. | Molekularität einer Reaktion ist die Anzahl der Moleküle oder Ionen, die an einer Reaktion als Reaktanten teilnehmen. |
| Beziehung zu Reaktanten | |
| Reaktionsreihenfolge erklärt, wie sich die Reaktantenkonzentration auf die Reaktionsgeschwindigkeit auswirkt. | Molekularität gibt die Anzahl der Reaktanten, die an einer Reaktion teilnehmen. |
Zusammenfassung - Reaktionsreihenfolge gegen Molekularität
Das Geschwindigkeitsgesetz zeigt an, dass die Geschwindigkeit des Fortschreitens einer chemischen Reaktion (bei konstanter Temperatur) proportional zu den Konzentrationen der Reaktanten ist, die zu den Exponenten angehoben werden, die experimentell bestimmt werden. Reaktionsreihenfolge wird in Bezug auf einen Reaktanten angegeben. Es erklärt die Abhängigkeit der Reaktionsgeschwindigkeit von Reaktantenkonzentrationen. Der Schlüsselunterschied zwischen Reaktionsreihenfolge und Molekularität besteht darin, dass die Reaktionsordnung die Beziehung zwischen der Konzentration einer chemischen Spezies und der Reaktion ergibt.
Referenz:
1. „Das Tarifgesetz.”Chemistry Libretexten, Libretexte, 21. Juli 2016, hier erhältlich.
2. „Reaktionsordnung.”Chemistry Libretexten, Libretexte, 21. Juli 2016, hier erhältlich.
3. „Molekularität und Kinetik.”Chemistry Libretexten, Libretexte, 21. Juli 2016, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "RatelogLogplot" von Fabiuccio ~ Enwikibooks bei English Wikibooks - Transfer von EN.Wikibooks zu Commons., (Public Domain) über Commons Wikimedia
2. "Cis-trans-stilbene" von Pancrat-eigene Arbeit (CC BY-SA 3.0) über Commons Wikimedia


