Unterschied zwischen Oxidationspotential und Reduktionspotential
Der Schlüsselunterschied zwischen Oxidationspotential und Reduktionspotential besteht darin Das Oxidationspotential zeigt die Tendenz eines chemischen Elements an oxidiert. Im Gegensatz dazu zeigt das Reduktionspotential an, dass die Tendenz eines chemischen Elements reduziert werden soll.
Oxidationspotential und Reduktionspotential sind zwei Arten von Elektrodenpotentialwerten für chemische Spezies, die in Volt unter Standardbedingungen angegeben sind. Daher nennen wir sie das Standard -Oxidationspotential und das Standardreduktionspotential. Der Wert dieser Potentiale bestimmt die Fähigkeit einer bestimmten chemischen Spezies, Oxidation/Reduktion zu unterziehen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Oxidationspotential
3. Was ist Reduktionspotential
4. Seite für Seitenvergleich - Oxidationspotential gegenüber Reduktionspotential in tabellarischer Form
5. Zusammenfassung
Was ist Oxidationspotential?
Das Oxidationspotential ist ein Wert, der die Tendenz einer chemischen Spezies angibt, um zu oxidieren. Mit anderen Worten, es ist die Fähigkeit einer Elektrode, Elektronen zu verlieren (oxidiert zu werden). Normalerweise wird dieser Wert unter Standardbedingungen angegeben. Daher sollten wir es als Standard -Oxidationspotential nennen. Die Bezeichnung für diesen Begriff ist SOP. Es wird in Volt gemessen. Und das ist dem Standard -Reduktionspotential sehr ähnlich, aber sie unterscheiden sich im Zeichen des Wertes, i.e. Der Wert des Standardoxidationspotentials ist der negative Wert des Standardreduktionspotentials. Wir können das Oxidationspotential als halbe Reaktion schreiben. Die allgemeine Formel für eine Oxidationsreaktion und das Oxidationspotential für Kupfer finden Sie nachstehend:

Halbe Reaktion der Kupferoxidation: Cu(S) ⟶ cu2+ + 2e-
Der Wert für das Standardoxidationspotential für die obige Reaktion (Oxidation von Kupfer) beträgt -0.34 v.
Was ist Reduktionspotential
Reduktionspotential ist die Tendenz einer bestimmten chemischen Spezies, sich zu reduzieren. Das bedeutet; Diese spezielle chemische Spezies ist bereit, Elektronen von außen zu akzeptieren (um reduziert zu werden). Es wird in Volt gemessen und normalerweise unter Standardbedingungen gemessen. Daher können wir es als Standard -Reduktionspotential nennen. Die Bezeichnung für diesen Begriff ist SRP. Wir können es in Form einer Reduktion halbreaktion schreiben. Die allgemeine Formel und das Kupfer als Beispiel sind unten angegeben:

Halbe Reaktion der Kupferreduktion: Cu2+ + 2e- ⟶ cu(S)
Der Wert für das Standardreduktionspotential für die obige Reaktion (Reduktion von Kupfer) beträgt 0.34 V, das ist der genau. Daher können wir eine Beziehung zwischen den Standard -Oxidations- und Reduktionspotentialen wie folgt aufbauen:
E00(Srp) = -e00(SOP)
Was ist der Unterschied zwischen Oxidationspotential und Reduktionspotential?
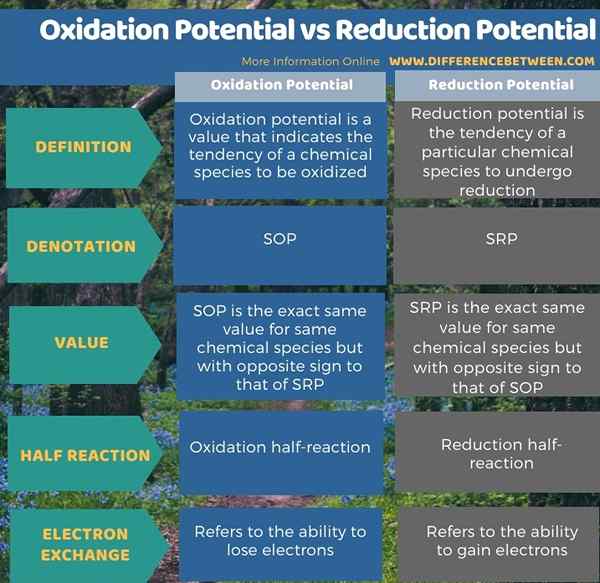
Oxidationspotential und Reduktionspotential sind zwei Arten von Elektrodenpotentialwerten für chemische Spezies, die in Volt unter Standardbedingungen angegeben sind. Der Schlüsselunterschied zwischen Oxidationspotential und Reduktionspotential besteht darin, dass das Oxidationspotential auf die Tendenz eines chemischen Elements oxidieren wird, während das Reduktionspotential die Tendenz eines chemischen Elements anzeigt, um zu reduzieren. Da diese potenziellen Werte unter Standardbedingungen gemessen werden, sollten wir sie als Standard -Oxidationspotential und Standardreduktionspotential benennen.
Darüber hinaus bezeichnen wir sie als SOP und SRP. Darüber hinaus besteht eine Beziehung zwischen diesen beiden Begriffen; Das Standard -Oxidationspotential ist genau der gleiche Wert, aber mit einem anderen Vorzeichen als das des Standard -Reduktionspotentials.
Die folgende Infografik fasst den Unterschied zwischen Oxidationspotential und Reduktionspotential zusammen.

Zusammenfassung -Oxidationspotential gegenüber Reduktionspotential
Das Oxidationspotential und das Reduktionspotential sind zwei Arten von Elektrodenpotentialwerten für chemische Spezies, die in Volt unter Standardbedingungen angegeben sind. Der Schlüsselunterschied zwischen Oxidationspotential und Reduktionspotential besteht darin, dass das Oxidationspotential auf die Tendenz eines chemischen Elements oxidieren wird, während das Reduktionspotential die Tendenz eines chemischen Elements anzeigt, um zu reduzieren.
Referenz:
1. "Standard -Reduktionspotential". Chemie -Libretexten, 2019, hier erhältlich.


