Unterschied zwischen gepaarten und ungepaarten Elektronen
Paarte Elektronen in einem Atom treten als Paare in einem Orbital auf, aber ungepaarte Elektronen treten nicht als Elektronenpaare oder Paare auf. Der Schlüsselunterschied Zwischen gepaarten und ungepaarten Elektronen befindet sich die gepaarte Elektronen verursachen Atome -Diamagnetismus, während die ungepaarten Elektronen Paramagnetismus oder Ferromagnetismus in Atomen verursachen.
Elektronen sind subatomare Partikel in Atomen. Jedes Atom enthält mindestens ein Elektron. Im neutralen Zustand eines Atoms entspricht die Anzahl der Elektronen der Anzahl der Protonen im Atomkern. Wenn es jedoch eine elektrische Ladung hat, sind diese Zahlen ungleich (was die elektrische Ladung verursacht). Wir können die Elektronenkonfiguration für ein Atom schreiben. Es gibt die Anordnung von Elektronen in verschiedenen Energieniveaus. Diese Elektronenkonfiguration zeigt über die gepaarten und ungepaarten Elektronen in einem Atom. Lassen Sie uns nun diskutieren, was diese beiden Formen sind.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind gepaarte Elektronen
3. Was sind ungepaarte Elektronen
4. Nebeneinander Vergleich - gepaarte gegen ungepaarte Elektronen in tabellarischer Form
5. Zusammenfassung
Was sind gepaarte Elektronen?
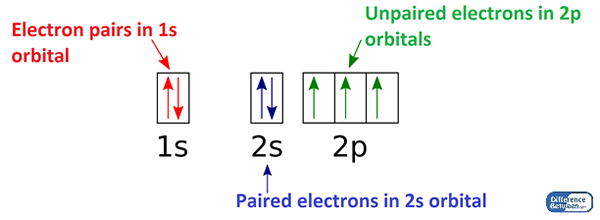
Gepaarte Elektronen sind die Elektronen in einem Atom, die in einem Orbital als Paare auftreten. Ein Orbital ist die Lage eines Elektrons in einem Atom; Anstelle eines bestimmten Ortes gibt es den Bereich, in dem sich ein Elektron um das Atom bewegt. Nach den modernen Theorien existieren die Elektronen in Orbitalen. Ein einfachste Orbital kann maximal zwei Elektronen halten. Wenn es zwei Elektronen in einem Orbital gibt, sagen wir, es gibt ein Paar Elektronen. Dies sind das gepaarte Elektron in einem Atom. Einige chemische Elemente mit all ihren Elektronen sind sehr stabil. Aber einige reaktiv. Die Stabilität hängt von der Elektronenkonfiguration des Atoms ab.

Abbildung 01: Anordnung von Elektronen in Orbitalen des Stickstoffatoms
Wenn wir die magnetischen Eigenschaften eines chemischen Elements betrachten, kann es drei Haupttypen von Magnetismus als diamagnetische, paramagnetische und ferromagnetische Elemente geben. Dieser Magnetismus hängt hauptsächlich von der Anzahl der ungepaarten Elektronen ab. Daher haben die gepaarten Elektronen keinen Beitrag zum Magnetismus. Dann können wir die chemischen Elemente mit allen Elektronen benennen, die als diamagnetische chemische Elemente gepaart wurden. Diamagnetismus bedeutet, dass er nicht für ein Magnetfeld anzieht.
Was sind ungepaarte Elektronen?
Ungepaarte Elektronen sind die Elektronen in einem Atom, die allein in einem Orbital auftreten. Dies bedeutet, dass diese Elektronen nicht gepaart sind oder als Elektronenpaare auftreten. Wir können leicht feststellen, ob in einem Atom ungepaarte Elektronen vorhanden sind, indem wir einfach seine Elektronenkonfiguration schreiben. Die Atome mit diesen Elektronen zeigen paramagnetische Eigenschaften oder ferromagnetische Eigenschaften.
Paramagnetische Materialien haben nur wenige ungepaarte Elektronen, während ferromagnetische Materialien mehr ungepaarte Elektronen haben. Somit ziehen ferromagnetische Materialien mit höherem Maße auf ein Magnetfeld an als das eines paramagnetischen Materials. Wenn ein Atom oder ein Molekül diese Art von Elektronen hat, nennen wir es ein freies Radikal. Die chemischen Elemente mit diesen Elektronen sind hochreaktiv. Dies liegt daran, dass sie dazu neigen, alle Elektronen zu kombinieren, um stabil zu werden. Ein ungepaartes Elektron zu haben ist instabil.
Was ist der Unterschied zwischen gepaarten und ungepaarten Elektronen?
Paarte Elektronen sind die Elektronen in einem Atom, die in einem Orbital als Paare auftreten, während ungepaarte Elektronen die Elektronen in einem Atom sind, die allein in einem Orbital auftreten. Daher treten gepaarte Elektronen immer als ein paar Elektronen auf, während ungepaarte Elektronen als einzelne Elektronen im Orbital auftreten. Dies ist der grundlegende Unterschied zwischen gepaarten und ungepaarten Elektronen. Darüber hinaus verursachen die gepaarten Elektronen einen Diamagnetismus von Atomen, während die ungepaarten Elektronen Paramagnetismus oder Ferromagnetismus in Atomen verursachen. Wir können dies als Hauptunterschied zwischen gepaarten und ungepaarten Elektronen sagen.
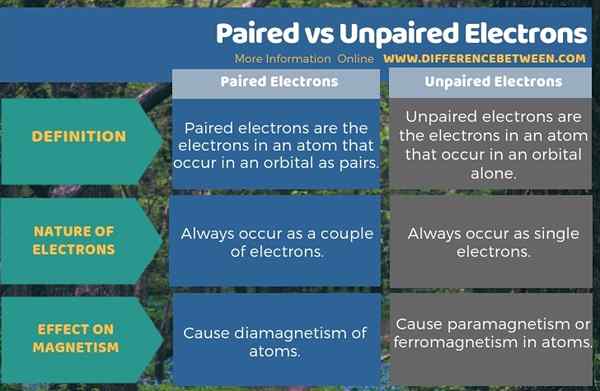
Zusammenfassung -gepaarte gegen ungepaarte Elektronen
Elektronen treten in Atomorbitalen auf. Sie sind in freier Bewegung um den Atomkern. Diese Elektronen können in zwei Arten als gepaarte oder ungepaarte Elektronen auftreten. Der Unterschied zwischen gepaarten und ungepaarten Elektronen besteht darin, dass gepaarte Elektronen den Diamagnetismus von Atomen verursachen, während ungepaarte Elektronen den Paramagnetismus oder den Ferromagnetismus in Atomen verursachen.
Referenz:
1. „Ungepaartes Elektron.Wikipedia, Wikimedia Foundation, 3. Juli 2018. Hier verfügbar


