Unterschied zwischen pH und titratierbarer Säure
Der Schlüsselunterschied zwischen pH und titratierbarer Säure ist, dass die pH misst die Konzentration freier Protonen in einer Lösung, während titratierbar.
Die Säure einer Lösung misst die Fähigkeit dieser Lösung, eine Basis zu neutralisieren. Dies liegt daran. Wenn die Säure mit der Base reagiert, reagieren die H+ -Ionen und OH-Ionen miteinander, um Wassermoleküle zu bilden (H2O). Daher ist es eine Neutralisationsreaktion.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist pH
3. Was ist titratable Säure
4. Seite an Seite Vergleich - pH vs titratable Säure in tabellarischer Form
5. Zusammenfassung
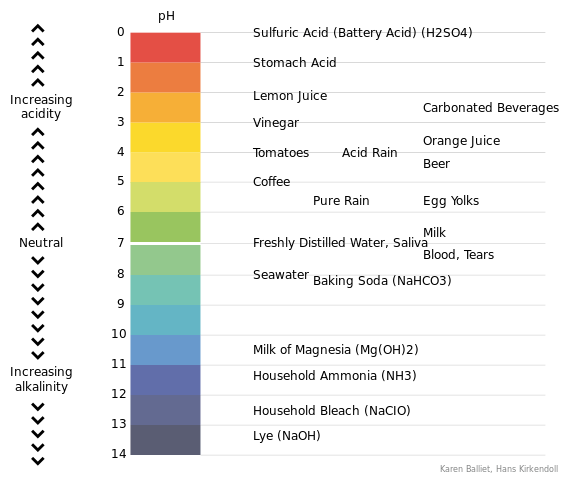
Was ist pH?
Der pH -Wert ist eine Messung der Konzentration freier Protonen (H+ -Ionen) in einer Lösung. Diese Protonen sind die H+ -Ionen, die sich von Säuren dissoziieren. Durch Messung des pH -Werts einer Lösung können wir daher die Säurefestigkeit einer Lösung messen. Dies bedeutet, dass wir die Fähigkeit dieser Lösung messen können, eine Basis zu neutralisieren. Wenn eine Lösung sauer ist, beträgt der pH -Wert weniger als 7. Wenn die Lösung jedoch alkalisch ist, liegt der pH dieser Lösung über 7.

Abbildung 01: pH -Skala
Wir betrachten den pH 7 als den neutralen pH -Wert. Wir können den pH -Wert einer Lösung mit einem pH -Messgerät messen. Die Gleichung für die Berechnung des pH -Werts unter Verwendung der freien Protonenkonzentration ist wie folgt;
PH = -Log [H+]
Was ist titratable Säure?
Titratable Säure (TA) ist ein Maß für die Gesamtsäure als ungefährer Wert. Dies bedeutet, dass die titratable Säure die Summe freier Protonen und nicht gestalteten Säuren in einer Lösung ergibt. Es handelt sich jedoch um eine Annäherung an die Gesamtsäure, da es nicht alle sauren Spezies in der Lösung messen kann (Gesamtsäure ist eine genauere Messung).
Die Messeinheit dieses Parameters beträgt Gramm pro Liter (g/l). Darüber hinaus gibt dieser Säure die Gesamtkonzentration von Protonen in einer Lösung, die mit einer starken Basis reagieren kann, um die Basis zu neutralisieren. EX: NaOH ist eine starke Basis, die üblicherweise bei der Messung von ta verwendet wird.
Was ist der Unterschied zwischen pH und titratierbarer Säure?
PH ist ein Maß für die Konzentration von freien Protonen (H+ -Ionen) in einer Lösung, und dieser Parameter ist uneinheitlich ohne. Titratable Säure (TA) ist ein Maß für die Gesamtsäure als ungefährer Wert. Die Messeinheit für diesen Parameter beträgt Gramm pro Liter (g/l). Dies ist der Hauptunterschied zwischen pH und titratierbarer Säure.

Zusammenfassung -pH vs titratable Säure
pH- und titratable Säure sind sehr wichtige Parameter bei der Bestimmung der Bodenqualität mithilfe einer Bodenlösung. Der Unterschied zwischen pH und titratierbarer Säure besteht darin, dass der pH die Konzentration von freien Protonen in einer Lösung misst, während die titratable Säure ein Maß für die Summe der freien Protonen und nicht gestalteten Säuren in einer Lösung ist.
Referenz:
1. „Titratable Säure.”Milch das Funk Wiki. Hier verfügbar
2. „Ph.Wikipedia, Wikimedia Foundation, 2. Juli 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Leistung von Wasserstoff (pH) -Becher Hans Kirkendoll - eigene Arbeit, (CC0) über Commons Wikimedia


