Unterschied zwischen physikalischem und chemischem Gleichgewicht
Schlüsselunterschied - physisch vs Chemisch Gleichgewicht
Ein Gleichgewichtszustand beschreibt die Konzentrationen von Reaktanten und Produkten in einem Reaktionsgemisch in einem geschlossenen System. Ein Gleichgewicht kann nur in einem geschlossenen System stattfinden. Im Gleichgewicht bleiben die Konzentrationen von Reaktanten und Produkten bei konstanten Werten. Wenn sich die Anzahl der Reaktanten oder Produkte geändert hat, wird auch die Konzentration anderer Bestandteile spontan geändert, um das Gleichgewicht zu halten. Basierend auf den Eigenschaften des Gleichgewichts gibt es zwei Arten; physikalisches Gleichgewicht und chemisches Gleichgewicht. Der Schlüsselunterschied Zwischen physikalischem und chemischem Gleichgewicht ist das Ein physikalisches Gleichgewicht ist ein Gleichgewicht, bei dem sich der physikalische Zustand des Systems nicht ändert, während das chemische Gleichgewicht der Gleichgewichtszustand ist, in dem sich die Konzentrationen von Reaktanten und Produkten mit der Zeit nicht verändert.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist physisches Gleichgewicht
3. Was ist chemisches Gleichgewicht
4. Ähnlichkeiten zwischen physikalischem und chemischem Gleichgewicht
5. Seite an Seitenvergleich - physikalisches gegen chemisches Gleichgewicht in tabellarischer Form
6. Zusammenfassung
Was ist physisches Gleichgewicht?
Ein physikalisches Gleichgewicht ist ein Gleichgewichtszustand, in dem sich der physikalische Zustand des Systems nicht ändert. Änderung der Phase der Materie von einer Phase zur anderen ist ein physischer Prozess. Daher wird der Gleichgewichtszustand, in dem sich der physikalische Zustand nicht mit der Zeit ändert. Es gibt drei Haupttypen des physikalischen Gleichgewichts;
-
Feststoff-Flüssigkeitsgleichgewicht
Zum Beispiel ist das Gleichgewicht zwischen Eis und Wasser ein physikalisches Gleichgewicht, da keine chemischen Reaktionen stattfinden. Jede reine Substanz kann sowohl in festen als auch in flüssigen Phasen am Schmelzpunkt dieser Substanz koexistieren. Der Schmelzpunkt ist die Temperatur, bei der die feste Substanz zu schmelzen beginnt (umgewandelt in seine flüssige Form).
-
Flüssig-Vapour-Gleichgewicht
Das Gleichgewicht zwischen Wasser und Dampf ist ein physikalisches Gleichgewicht, bei dem keine chemischen Reaktionen stattfinden. Diese Art des Gleichgewichts tritt jedoch nur in geschlossenen Systemen auf, es sei denn, der Dampf entkommt aus dem Gleichgewicht.
-
Solid-Vapour-Gleichgewicht
Diese Art des physikalischen Gleichgewichts kann in Substanzen beobachtet werden, die sich einer Sublimation unterziehen. Dort tritt das Gleichgewicht bei der Sublimationstemperatur auf (Sublimation ist die Umwandlung eines Feststoffs direkt in die Dampfphase, ohne eine flüssige Phase zu bestehen). Zum Beispiel Umwandlung von festem Ammoniumchlorid (NH4Cl) in gasförmiges Ammoniumchlorid.
Was ist chemisches Gleichgewicht?
Chemisches Gleichgewicht ist der Gleichgewichtszustand, in dem die Konzentrationen von Reaktanten und Produkten mit der Zeit nicht verändert werden. Diese Art von Gleichgewicht kann bei reversiblen chemischen Reaktionen beobachtet werden. Das chemische Gleichgewicht führt dazu. Es gibt keine Nettoveränderungen in den Konzentrationen jedes Reaktanten und jedes Produkts, die an Gleichgewichtsreaktionen beteiligt sind.

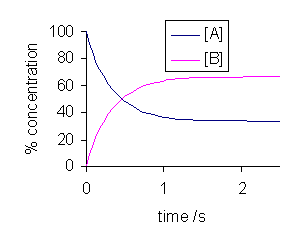
Abbildung 1: Diagramm der Reaktion zwischen A und B; Die Reaktantenkonzentrationen werden konstant, nachdem das Reaktionsgemisch ein Gleichgewicht erhalten hat
Zum Beispiel ergibt die Reaktion zwischen Wasserstoffgas und Joddampf in einem geschlossenen System eine tiefe violette Farbe zu Beginn, die dann mit der Zeit verblasst. Die tiefe violette Farbe wird von Joddampf gegeben. Die Farbe verblasst aufgrund der Reaktion zwischen Joddampf und Wasserstoffgas. Nach einiger Zeit bleibt die Farbe konstant. Es ist der Punkt, an dem die Reaktion einen Gleichgewichtszustand erhalten hat. Dies ist ein chemisches Gleichgewicht.
H2 (g) + ICH2 (g) ↔ Hallo(G)
Was sind die Ähnlichkeiten zwischen physikalischem und chemischem Gleichgewicht?
- Sowohl physikalisches als auch chemisches Gleichgewicht sind Formen von Gleichgewichtszuständen.
- Sowohl physikalische als auch chemische Gleichgewichtsformen haben Parameter, die mit der Zeit konstant sind.
Was ist der Unterschied zwischen physikalischem und chemischem Gleichgewicht?
Physikalisches gegen chemisches Gleichgewicht | |
| Ein physikalisches Gleichgewicht ist ein Gleichgewichtszustand, in dem sich der physikalische Zustand des Systems nicht ändert. | Chemisches Gleichgewicht ist der Gleichgewichtszustand, in dem die Konzentrationen von Reaktanten und Produkten mit der Zeit nicht verändert werden. |
| Natur | |
| Physikalische Gleichgewicht zeigen keine Veränderung der physikalischen Zustände der Materie, die am Gleichgewicht beteiligt ist. | Chemische Gleichgewichts zeigen keine Veränderungen der Konzentrationen von Reaktanten und Produkten, die am Gleichgewicht beteiligt sind. |
| Theorie | |
| Das physikalische Gleichgewicht umfasst die Koexistenz zweier physikalischer Zustände innerhalb desselben geschlossenen Systems. | Das chemische Gleichgewicht umfasst die gleichen Raten von Vorwärts- und Rückwärtsreaktionen. |
Zusammenfassung -physisch vs Chemisch Gleichgewicht
Der Gleichgewichtszustand eines Systems ist der Zustand, in dem sich konstante Parameter in diesem System aufweisen. Basierend auf den Eigenschaften des Gleichgewichtszustands eines Systems gibt es zwei Gleichgewichtsformen; physikalisches Gleichgewicht und chemisches Gleichgewicht. Der Unterschied zwischen physikalischem und chemischem Gleichgewicht besteht darin, dass ein physikalisches Gleichgewicht ein Gleichgewicht ist, in dem sich der physikalische Zustand des Systems nicht ändert.
Referenz:
1.„Gleichgewichtstypen: physikalisches Gleichgewicht und chemisches Gleichgewicht.„Wissen neu definieren, 2. März. 2018. Hier verfügbar
2."Chemisches Gleichgewicht.”Wikipedia, Wikimedia Foundation, 2. März. 2018. Hier verfügbar
3.„Merkmale des Gleichgewichtszustands.”Chemistry Libretexten, Libretexte, 21. Juli 2016. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.'Dynamisches Gleichgewicht von Petergans bei English Wikipedia - eigene Arbeit (Public Domain) über Commons Wikimedia


