Unterschied zwischen reinen und hybriden Orbitalen
Der Schlüsselunterschied Zwischen reinen und hybriden Orbitalen befindet sich die Reine Orbitale sind die ursprünglichen Atomorbitale, während die Hybridorbitale aus der Mischung von zwei oder mehr Atomorbitalen bilden.
Bei der Bildung chemischer Bindungsbildung einfacher Moleküle können wir einfach die Überlappung von Atomorbitalen berücksichtigen. Wenn wir jedoch die chemische Bindung in komplexen Molekülen diskutieren wollen, müssen wir wissen, was Orbitalhybridisierung ist. Orbitalhybridisierung ist das chemische Konzept, das die Mischung von Atomorbitalen beschreibt, um neue Hybridorbitale zu bilden. Diese Orbitale beinhalten die Bildung kovalenter chemischer Bindungen.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind reine Orbitale
3. Was sind Hybridorbitale
4. Seite an Seitenvergleich - reine VS -Hybridorbitale in tabellarischer Form
5. Zusammenfassung
Was sind reine Orbitale?
Reine Orbitale sind Atomorbitale, die Elektronen des Atoms enthalten. Diese Orbitale sind keine gemischten Orbitale wie Hybridorbitale. Das Orbital gibt den wahrscheinlichsten Ort von Elektronen in einem Atom an, da sich die Elektronen in kontinuierlicher Bewegung um den Atomkern befinden. Anstelle eines festen Ortes gibt dies einen Bereich, in dem das Elektron zu einem bestimmten Zeitpunkt auftreten kann.
Die reinen atomaren Orbitale existieren in mehreren Formen wie kugelförmige Form, Hantelform. Nach der Quantenmechanik gibt es eine Reihe von Quantennummern, mit denen wir ein Orbital benennen können. Dieser Satz von Zahlen umfasst N (Hauptquantennummer), L (Quantennummer), M (magnetische Quantenzahl) und S (Spin -Quantenzahl). Jedes Orbital nimmt maximal zwei Elektronen ein. Gemäß der Quantenzahl der Winkelimpuls gibt es vier allgemein bekannte Atomorbitale als S-Orbital (kugelförmig), p orbital (dumbbellförmig), D-Orbital (zwei Hanteln in derselben Ebene) und F-Orbital (eine komplizierte Struktur).
Was sind Hybridorbitale?
Hybridorbitale sind die molekularen Orbitale, die sich aus der Mischung von Atomorbitalen bilden. Dies sind hypothetische Orbitale. Die Mischung erfolgt zwischen den Atomorbitalen desselben Atoms. Diese Mischung erfolgt, um eine kovalente chemische Bindung mit einem anderen Atom zu bilden. Der Prozess dieser Mischung ist „orbitale Hybridisierung“, die zu Hybridorbitalen führt. Wir nennen diese Orbitale gemäß den atomaren Orbitalen, die einer Hybridisierung unterzogen werden.

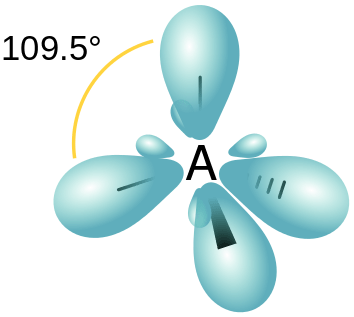
Abbildung 01: SP3 -Hybridisierung
Dementsprechend sind die drei Hauptformen von Hybridorbitalen:
- SP Hybrid Orbital - Dies bildet sich aufgrund der Hybridisierung von S- und P -Atomorbitalen. Daher hat das resultierende hybride Orbital 50% S -Eigenschaften und 50% P -Orbitaleigenschaften. Dieses hybride Orbital hat eine lineare räumliche Anordnung.
- sp2 Hybrid Orbital - Dies bildet sich aufgrund der Hybridisierung von einem S und zwei P -Orbitalen. Daher hat das resultierende hybride Orbital 33% der S -Orbitaleigenschaften und 66% der P -Orbitalmerkmale. Die räumliche Anordnung ist trigonaler Planar.
- sp3 Hybrid Orbital - Dies bildet sich aufgrund der Hybridisierung von einem S und drei P -Orbitalen. Daher hat das resultierende hybride Orbital 25% S -Eigenschaften und 75% P -Eigenschaften. Die räumliche Anordnung dieser Hybridorbitale ist tetraedrisch.
Was ist der Unterschied zwischen reinen und hybriden Orbitalen?
Reine Orbitale sind Atomorbitale, die Elektronen des Atoms enthalten, während Hybridorbitale die molekularen Orbitale sind, die sich aus der Mischung von Atomorbitalen bilden. Dies ist der Hauptunterschied zwischen reinen und hybriden Orbitalen. Darüber hinaus bilden sich die Hybridorbitale durch Orbitalhybridisierung, aber reine Orbitale werden nicht hybridisiert. Darüber hinaus ist die Bildung von Hybridorbitalen für die Bildung komplizierter chemischer Verbindungen durch Bildung kovalenter chemischer Bindungen wichtig. Wenn wir die Nomenklatur von Orbitalen berücksichtigen, nennen wir reine Orbitale als S-, P-, D- und F -Orbitale, während wir hybride Orbitale als sp, sp, SP nennen2, sp3, usw.
Die folgende Infografik tabelt den Unterschied zwischen reinen und hybriden Orbitalen als Schnellreferenz auf.
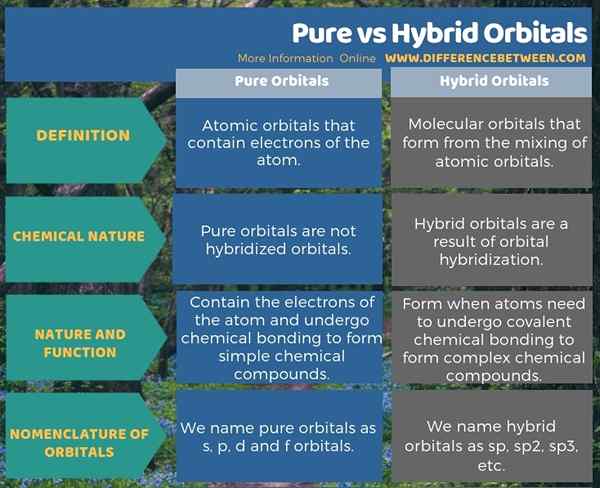
Zusammenfassung -reine gegen Hybridorbitale
Atom -Orbitale sind die Regionen, in denen Elektronen in Atomen existieren. In diesem Artikel haben wir zwei Arten von Orbitalen als reine und hybride Orbitale beschrieben. Der Hauptunterschied zwischen reinen und hybriden Orbitalen besteht darin, dass reine Orbitale die ursprünglichen Atomorbitale sind, während sich hybride Orbitale aus der Mischung von zwei oder mehr Atomorbitalen bilden.
Referenz:
1. Libretexten. „Hybridorbitale.”Chemistry Libretexten, Libretexte, 21. Juli 2016. Hier verfügbar
Bild mit freundlicher Genehmigung:
1.”Ae4h” von jfmelero - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia