Unterschied zwischen quaternärem Ammonium und Ammoniak
Der Schlüsselunterschied Zwischen quartärem Ammonium und Ammoniak ist das Das quaternäre Ammoniakmolekül hat ein zentrales Stickstoffatom, das an vier Alkylgruppen gebunden ist, während Ammoniakmolekül ein Stickstoffzentrum enthält, das an drei Wasserstoffatome gebunden ist.
Quaternäres Ammonium ist ein Kation, das aus einem normalen Ammoniakmolekül stammt. Hier werden die drei Wasserstoffatome des Ammoniakmoleküls durch ähnliche oder verschiedene Alkylgruppen ersetzt, und über sein einsames Elektronenpaar gibt es eine zusätzliche Alkylgruppe, die an das Stickstoffatom gebunden ist.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist quaternäres Ammonium
3. Was ist Ammoniak
4. Seite an Seitenvergleich - quaternäres Ammonium gegen Ammoniak in tabellarischer Form
5. Zusammenfassung
Was ist quaternäres Ammonium?
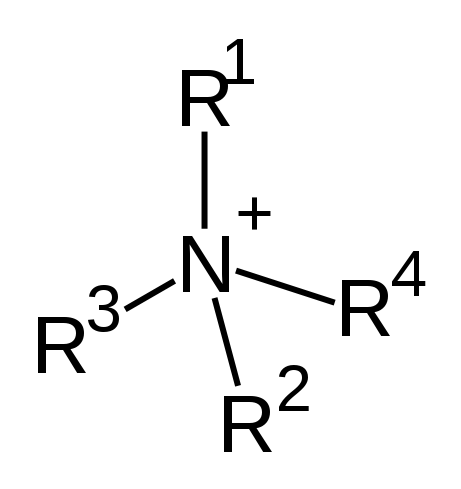
Das quaternäre Ammonium ist ein Kation, das aus Ammoniakmolekül abgeleitet ist, und hat ein zentrales Stickstoffatom mit vier Alkylgruppen, die darauf ersetzt werden. Daher kann die chemische Formel dieses Moleküls als [n-r1R2R3R4]+. Die chemische Struktur dieses Kationen lautet wie folgt:

Abbildung 01: Chemische Struktur des quaternären Ammoniumkation
Diese Kationen werden als Quats abgekürzt. Sie sind positiv geladene Polyatomionen. Es gibt mehrere Ionen, die durch Ammoniakmolekül gebildet werden, einschließlich primärer, sekundärer und tertiäres Ammoniak. Diese sind gemäß der Anzahl der an das Stickstoffatom gebundenen Alkylgruppen benannt.
Die häufigsten Verbindungen von quaternärem Ammonium sind quaternäre Ammoniumsalze. Diese Verbindungen können durch Alkylierung von tertiären Aminen in Gegenwart von Halkohlenwasserstoffen hergestellt werden. Im Allgemeinen sind quaternäre Ammoniumkationen selbst starke Oxidationsmittel, starke Säuren und Elektrophile nicht reaktiv. Diese Kationen werden jedoch in Gegenwart außergewöhnlich starker Stützpunkte abbaut.
Was ist Ammoniak?
Ammoniak ist eine anorganische Verbindung mit der chemischen Formel NH3. Es ist eine gasförmige Substanz und das einfachste Pnictogen -Hydrid. Ammoniak tritt als farbloses Gas mit einem scharfen, irritierenden Geruch auf. Der IUPAC -Name Ammoniak ist Azane.
Die chemische Formel ist NH3. Daher beträgt die Molmasse 17.03 g/mol. Der Schmelzpunkt von Ammoniak beträgt –77.73 ° C, und der Siedepunkt ist –33.34 ° C.
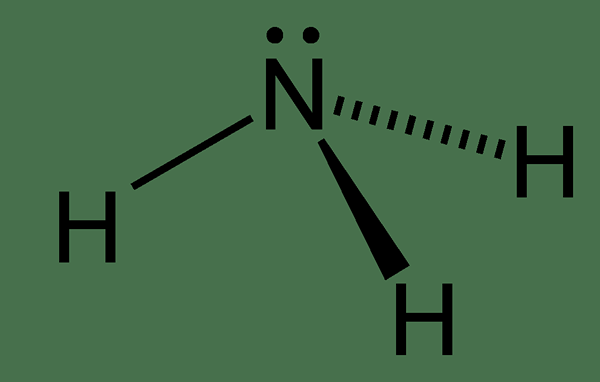
Abbildung 02: Struktur des Ammoniakmoleküls
Bei der Betrachtung des Auftretens von Ammoniakgas tritt es natürlich in der Umwelt vor. Manchmal finden wir auch Ammoniak im Regenwasser. In unserem Körper sezernieren Nieren Ammoniak, um überschüssige Säure zu neutralisieren.
In der chemischen Struktur des Ammoniakmoleküls hat es ein Stickstoffatom, das an drei Wasserstoffatome gebunden ist. Da es fünf Elektronen in der äußersten Elektronenhülle des Stickstoffs gibt, gibt es ein einsames Elektronenpaar am Stickstoffatom des Ammoniakmoleküls. Daher ist die Geometrie des Ammoniakmoleküls trigonaler Pyramiden. Darüber hinaus können wir diese Verbindung leicht verflüssigen. Dies liegt daran, dass es in der Lage ist, Wasserstoffbrückenbindungen zwischen Ammoniakmolekülen zu bilden.
Was ist der Unterschied zwischen quaternärem Ammonium und Ammoniak?
Quaternäres Ammonium ist ein Kation, das aus einem Ammoniakmolekül abgeleitet ist. Der Schlüsselunterschied zwischen quaternärem Ammonium und Ammoniak besteht darin, dass das quaternäre Ammoniakmolekül ein zentrales Stickstoffatom aufweist.
Die folgende Tabelle fasst den Unterschied zwischen quaternärem Ammonium und Ammoniak zusammen.

Zusammenfassung -quaternäres Ammonium gegen Ammoniak
Quaternäres Ammonium ist ein Kation, das aus einem Ammoniakmolekül abgeleitet ist. Der Schlüsselunterschied zwischen quaternärem Ammonium und Ammoniak besteht darin, dass das quaternäre Ammoniakmolekül ein zentrales Stickstoffatom aufweist.
Referenz:
1. „Quaternäre Ammoniumverbindungen.” Quaternäre Ammoniumverbindungen - Ein Überblick | Sciencedirect -Themen, Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Ammonia-2d" von Radio89-eigene Arbeit (CC BY-SA 3.0) über Commons Wikimedia
2. "Quaternäres Ammoniumkation" von fvasconcellos - eigene Arbeit (Public Domain) über Commons Wikimedia


