Differenz zwischen Halbäquivalenzpunkt und Äquivalenzpunkt
Der Schlüsselunterschied Zwischen halb gleichwertiger Punkt und Äquivalenzpunkt ist das Der halbe Äquivalenzpunkt ist der Mittelpunkt zwischen dem Ausgangspunkt und dem Äquivalenzpunkt einer bestimmten Titration, während der Äquivalenzpunkt der chemischen Reaktion endet.
Titrationen sind analytische Techniken in der Chemie, die für die Bestimmung der unbekannten Konzentrationen gegebener Proben wichtig sind.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Äquivalenzpunkt
3. Was ist der halbe Äquivalenzpunkt
4. Seite für Seitenvergleich - Halbäquivalenzpunkt gegen Äquivalenzpunkt in tabellarischer Form
5. Zusammenfassung
Was ist der halbe Äquivalenzpunkt?
Der halbe Äquivalenzpunkt einer Titration ist die halbe Strecke zwischen dem Äquivalenzpunkt und dem Startpunkt (Ursprung). Die Bedeutung dieses Punktes ist, dass an diesem Punkt der pH -Wert der Analytlösung gleich der Dissoziationskonstante oder PKA der in der Titration verwendeten Säure ist. Der halbe Äquivalenzpunkt tritt am einem halben Volumen des ersten Äquivalenzpunkts der Titration auf. Wenn es in der Titration mehrere Äquivalenzpunkte gibt, gibt es mehrere halbe Äquivalenzpunkte, die der Anzahl der Äquivalenzpunkte entsprechen. Zum Beispiel tritt ein Äquivalenzpunkt in der zweiten Halbzeit im Mittelpunkt zwischen den ersten und zweiten Äquivalenzpunkten auf.
Was ist Äquivalenzpunkt?
Äquivalenzpunkt in einer Titration ist der tatsächliche Punkt, an dem die gewünschte chemische Reaktion im Reaktionsgemisch endet. Wir führen normalerweise Titrationen durch, um die Konzentration einer Substanz in einer Flüssigkeit zu bestimmen. Wenn wir die Substanz kennen. Hier nennen wir das Titrant als Standardlösung, da seine genaue Molarität bekannt ist.

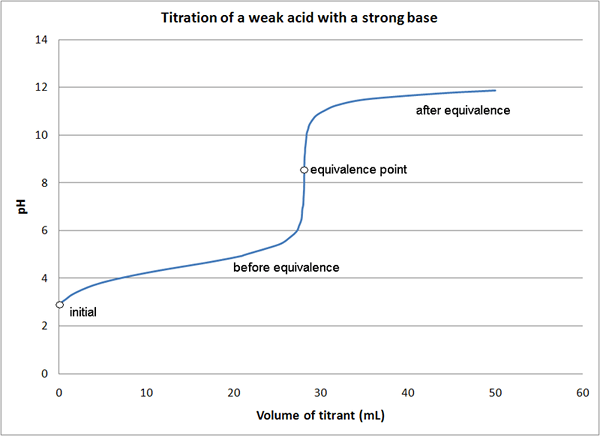
Abbildung 01: Titrationskurve, die den Äquivalenzpunkt anzeigt
Bei der Reaktion zwischen NaOH und HCl, bei der es sich um eine Säure-Base-Reaktion handelt, können wir entweder NaOH oder HCl als Titrant mit der bekannten Konzentration verwenden. Hier wird das Titrant in die Burette platziert, und langsam können wir es dem Titrand/Analyten hinzufügen, bis eine Farbänderung im Reaktionsgemisch auftritt. Wir müssen einen Indikator verwenden, da NaOH und HCL keine Selbstbekämpfung sind. Der Punkt, an dem eine Farbänderung auftritt, ist der Endpunkt der Titration, der nicht der Äquivalenzpunkt der Reaktion ist.
In dieser Titration ist der Äquivalenzpunkt der Punkt, an dem alle HCl -Moleküle mit NaOH reagiert haben (oder der Punkt, an dem alle NaOH -Moleküle mit HCl reagiert haben). Dann sollten die Mol des Titrans gleich den Molen des unbekannten Analyten sein, da die Stöchiometrie zwischen HCL und NaOH 1: 1 beträgt. Es gibt verschiedene Methoden, um den Äquivalenzpunkt einer Titration zu bestimmen.
- Farbwechsel von Selbstindikatoren - Bei Reaktionen mit Selbstindikatoren als Reaktanten zeigt die Farbänderung den Äquivalenzpunkt der Titration, da sie keine Indikatoren verwenden.
- Endpunkt- Manchmal kann der Äquivalenzpunkt als Endpunkt angesehen werden, da sie ungefähr gleich sind.
- Leitfähigkeit- Bei dieser Methode wird die Leitfähigkeit während der gesamten Titration gemessen, und der Äquivalenzpunkt ist dort, wo eine schnelle Leitfähigkeitsänderung auftritt. Dies ist eine etwas schwierige Methode.
- Spektroskopie- Dies ist eine Methode, die für farbenfrohe Reaktionsmischungen geeignet ist. Der Äquivalenzpunkt wird gemäß der schnellen Änderung der Wellenlängen bestimmt, die von der Probe absorbiert werden.
Was ist der Unterschied zwischen Halbäquivalenzpunkt und Äquivalenzpunkt?
Titrationen sind analytische Techniken in der Chemie, die für die Bestimmung der unbekannten Konzentrationen gegebener Proben wichtig sind. Der Schlüsselunterschied zwischen Halbäquivalenzpunkt und Äquivalenzpunkt besteht darin.
Die Tabulierung unten fasst die Differenz zwischen Halfäquivalenzpunkt und Äquivalenzpunkt zusammen.
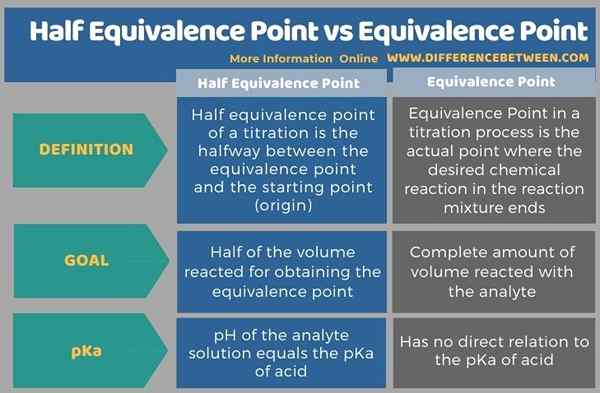
Zusammenfassung -Halbäquivalenzpunkt gegen Äquivalenzpunkt
Titrationen sind analytische Techniken in der Chemie, die für die Bestimmung der unbekannten Konzentrationen gegebener Proben wichtig sind. Der Schlüsselunterschied zwischen Halbäquivalenzpunkt und Äquivalenzpunkt besteht darin.
Referenz:
1. „Titrationskurven & Äquivalenzpunkt (Artikel).” Khan Akademie, Hier verfügbar.
Bild mit freundlicher Genehmigung:
1. "Titration von schwacher Säure mit starker Base" durch Quantenkinetik - eigene Arbeit (CC von 3.0) über Commons Wikimedia


