Unterschied zwischen Radon und Radium

Der Schlüsselunterschied Zwischen Radon und Radium ist das Radon ist ein edles Gas, während Radium ein radioaktives Element ist.
Obwohl die Namen Radon und Radium ähnlich klingen, sind sie völlig unterschiedliche chemische Elemente. Sie treten in verschiedenen physischen Zuständen auf. Beide Elemente sind jedoch aufgrund ihrer großen Atomzahl radioaktive Elemente.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Radon
3. Was ist Radium
4. Seite an Seitenvergleich - Radon gegen Radium in tabellarischer Form
5. Zusammenfassung
Was ist Radon?
Radon ist ein edles Gas mit dem chemischen Symbol RN und der Atomzahl 86. Es ist ein radioaktives Element aufgrund seiner großen Atomzahl, die es instabil macht. Es ist ein farbloses, geruchlos und geschmackloser Edelgas. Natürlich tritt dieses Element in den Zwischenschritten des radioaktiven Zerfalls von Thorium und Uran auf. Radon ist das mittlere Zerfallsprodukt von Radium. Die atomare Masse des häufigsten und stabilsten Isotops von Radon beträgt 222. Die Halbwertszeit dieses stabilen Isotops beträgt jedoch ungefähr 3.8 Tage. Da sein Verfall schnell auftritt, gehört Radon zu den seltensten chemischen Elementen der Erde.
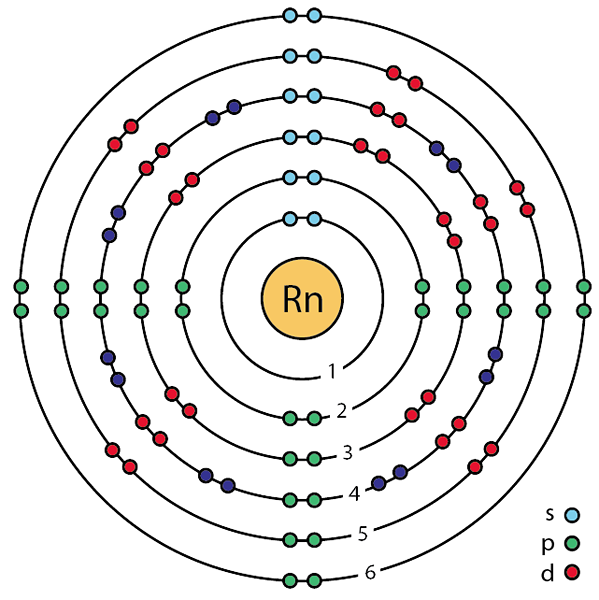
Abbildung 01: Radon
Radon ist ein P-Block-Element in Gruppe 18 und Periode 6. Es hat eine vollständige elektronische Struktur gemäß der Oktettregel. Es hat winzige Werte für Schmelzpunkte und Siedepunkt, was es zu einem wesentlichen Gas bei Raumtemperatur und Druckbedingungen macht. Darüber hinaus hat es eine Gesichts-zentrierte kubische Kristallstruktur. Bei der Betrachtung seiner magnetischen Eigenschaften ist es nichtmagnetisch, da es in Radonatomen keine ungepaarten Elektronen gibt. Darüber hinaus ist es das dichteste edle Gas, und es ist ein inerter Gas.
Was ist Radium?
Radium ist ein radioaktives chemisches Element mit dem chemischen Symbol RA und der Atomzahl 88. Es wird als alkalisches Erdmetall kategorisiert, weil es in der Gruppe 2 der Periodenzüchter ist. In seinem reinen Zustand erscheint es in weißer Farbe. Bei der Exposition gegenüber der Luft reagiert es leicht mit Stickstoff und bildet schwarz gefärbte Radiumnitrid. Das stabilste Isotop von Radium ist RA-226. Die Halbwertszeit dieses Isotops beträgt ungefähr 1600 Jahre.

Abbildung 02: Aussehen von reinem Radium
Radium befindet sich in Gruppe 2 und Periode 7 des Periodensystems. Es ist ein S-Block-Element. Es hat atomare Orbitale vollständig gefüllt, hat aber nicht alle Elektronen, um der Oktettregel zu befolgen. Bei Standardtemperatur und Druck kann dieses Element im Festkörperzustand existieren. Es hat eine körperzentrierte kubische Kristallstruktur. Da es keine ungepaarten Elektronen gibt, ist es nichtmagnetisch. Radium ist das einzige radioaktive Mitglied in Gruppe 2 der Periodenzüchtertabelle. In seinem reinen Zustand hat dieses chemische Element eine flüchtige Natur. Es hat sehr hohe Schmelz- und Siedepunkte.
Was ist der Unterschied zwischen Radon und Radium?
Der Hauptunterschied zwischen Radon und Radium besteht darin, dass Radon ein edles Gas ist, während Radium ein radioaktives Element ist. Beide Elemente sind jedoch radioaktiv, weil sie große Atomzahlen haben. Darüber hinaus ist Radon das Intermediate -Zerfall -Produkt von Radium. Darüber hinaus beträgt die Halbwertszeit von Radon ungefähr 3.8 Tage, während die Halbwertszeit von Radium etwa 1600 Jahre beträgt.
Die folgende Tabelle fasst den Unterschied zwischen Radon und Radium zusammen.
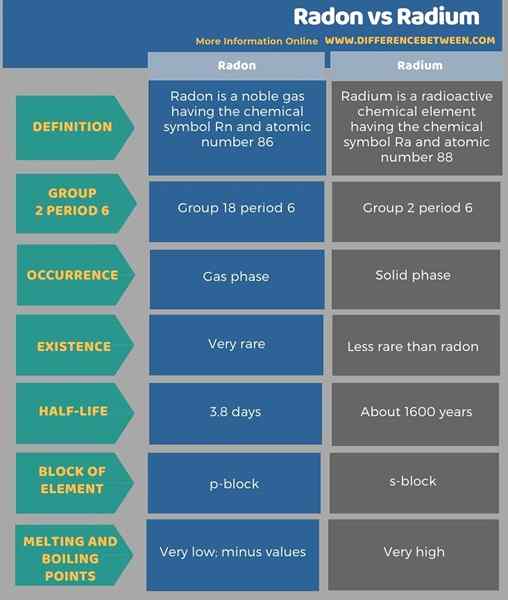
Zusammenfassung -Radon gegen Radium
Obwohl die Namen Radon und Radium ähnlich klingen, sind sie völlig unterschiedliche chemische Elemente. Der Hauptunterschied zwischen Radon und Radium besteht darin, dass Radon ein edles Gas ist, während Radium ein radioaktives Element ist. Beide Elemente sind jedoch radioaktiv, weil sie große Atomzahlen haben.
Referenz:
1. Hanusa, Timothy P. "Radium.”Encyclopædia Britannica, Encyclopædia Britannica, Inc., 14. März. 2019, hier erhältlich.
2. "Radium.”Wikipedia, Wikimedia Foundation, 24. April. 2020, hier erhältlich.
3. "Radon.”Wikipedia, Wikimedia Foundation, 20. Mai 2020, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "86 Radon (RN) Enhanced Bohr -Modell" von Ahazard.ScienceWriter - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Radium226" von Grenadier - eigene Arbeit (CC von 3.0) über Commons Wikimedia


