Unterschied zwischen polaren und dipolaren Molekülen
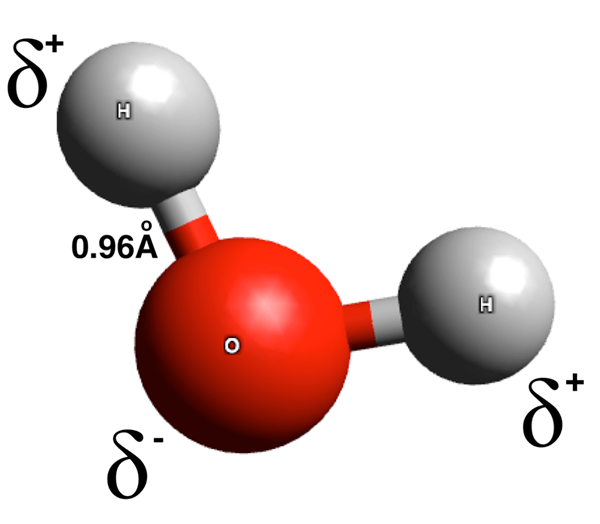
Der Schlüsselunterschied Zwischen polaren und dipolaren Molekülen ist das Polare Moleküle haben zwei entgegengesetzte Enden mit entgegengesetzten elektrischen Ladungen, während dipolare Moleküle zwei Pole haben.
Im Allgemeinen können wir die Begriffe polarer und dipolarer austauschbar verwenden, da beide Begriffe ein einzelnes Molekül mit zwei entgegengesetzten Enden beschreiben. Diese unterschiedlichen Enden ergeben sich aufgrund der Unterschiede in der Elektronenverteilung im gesamten Molekül.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind polare Moleküle
3. Was sind dipolare Moleküle
4. Seite für Seitenvergleich - polar vs dipolare Moleküle in tabellarischer Form
5. Zusammenfassung
Was sind polare Moleküle?
Polare Moleküle sind chemische Spezies mit polaren Bindungen. Die Summe der Dipolmomente dieser polaren Bindungen ist nicht gleich Null. Eine polare Bindung hat ein teilweise positives geladenes Ende und ein teilweise negatives geladenes Ende. Diese elektrischen Ladungen ergeben sich aufgrund der Unterschiede in der Elektronenverteilung während der gesamten chemischen Bindung. Der Unterschied in der Elektronenverteilung ist ein Ergebnis der Differenz des Elektronegativitätswerts von Atomen in der chemischen Bindung. Hier zieht das elektronegativere Atom die Elektronen des Bindungselektronenpaares auf sich selbst an, was diesem Atom eine teilweise negative Ladung verleiht. Folglich erhält das andere Atom in dieser Bindung eine teilweise positive Ladung aufgrund des Mangels an Elektronendichte um sie herum, was die positive Ladung der Protonen in den Atomkern zeigt.

Abbildung 01: Ladungstrennung in einem Wassermolekül
Außerdem kann sich ein polares Molekül bilden, wenn die räumliche Anordnung des Moleküls (Geometrie) die positiven Ladungen auf einer Seite des Moleküls und negative Ladungen auf der gegenüberliegenden Seite sammelt. Einige häufige Beispiele für Pappelmoleküle sind Wasser, Ammoniak, Ethanol, Schwefeldioxid und Wasserstoffsulfid.
Was sind dipolare Moleküle?
Dipolare Moleküle sind chemische Spezies mit zwei Polen im selben Molekül. Ein Dipolmoment tritt auf, wenn eine Trennung der elektrischen Ladungen aufgrund einer ungleichmäßigen Verteilung der Elektronen im gesamten Molekül vorhanden ist. Dipolmomente treten aufgrund der Unterschiede in den Elektronegativitätswerten von Atomen im Molekül auf. Im Gegensatz zu polaren Verbindungen sind dipolare Moleküle elektrisch neutral (die elektrische Gesamtladung des Moleküls beträgt Null). Dies liegt daran, dass die Ladungsetrennung des Moleküls genau den gleichen Wert der elektrischen Ladung mit genau der entgegengesetzten Ausrichtung zeigt, die sich gegenseitig abbricht. Somit gibt es keine Nettogebühr.
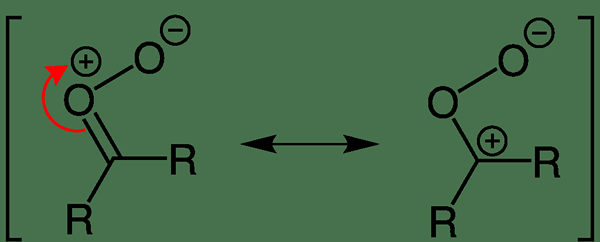
Abbildung 02: Delokalisierung der elektrischen Ladung in Carbonyloxid
In den meisten dipolaren Molekülen werden die Ladungen im gesamten Molekül delokalisiert. Einige Beispiele sind Carbonyloxid, Diazomethan, Phosphoniumklid usw.
Was ist der Unterschied zwischen polaren und dipolaren Molekülen?
Der Schlüsselunterschied zwischen polaren und dipolaren Molekülen besteht darin, dass polare Moleküle zwei entgegengesetzte Enden mit entgegengesetzten elektrischen Ladungen haben, während dipolare Moleküle zwei Pole aufweisen. Im Allgemeinen können wir jedoch die Begriffe polarer und dipolarer austauschbar verwenden, da beide Begriffe ein einzelnes Molekül mit zwei entgegengesetzten Enden beschreiben.
Außerdem besteht ein weiterer signifikanter Unterschied zwischen polaren und dipolaren Molekülen darin, dass sich polare Moleküle bilden.
Unten finden Sie eine zusammenfassende Tabelle des Unterschieds zwischen polaren und dipolaren Molekülen.

Zusammenfassung - Polar vs dipolare Moleküle
Kurz gesagt, wir können die Begriffe polarer und polar austauschbar verwenden, da beide Begriffe ein einzelnes Molekül mit zwei entgegengesetzten Enden beschreiben. Der Schlüsselunterschied zwischen polaren und dipolaren Molekülen besteht darin, dass polare Moleküle zwei entgegengesetzte Enden mit entgegengesetzten elektrischen Ladungen haben, während dipolare Moleküle zwei Pole aufweisen.
Referenz:
1. „13.3: Bond Polarität und Dipolmomente.”Chemistry Libretexten, Libretexten, 3. Juni 2019, hier verfügbar.
2. „Dipolare Verbindung.”Wikipedia, Wikimedia Foundation, 13. Juli 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Ball- und Stick -Modell eines Wassermoleküls" von Soonlorpai - eigene Arbeit (CC BY -SA 4.0) über Commons Wikimedia
2. "Carbonyloxid (Criegee Zwitterion)" von Wickey -NL - eigener Arbeit (CC0) über Commons Wikimedia


