Differenz zwischen Reaktionsgeschwindigkeit und Geschwindigkeitskonstante
Der Schlüsselunterschied zwischen Reaktionsgeschwindigkeit und Geschwindigkeitskonstante ist das Die Reaktionsrate ist die Geschwindigkeit, mit der Reaktanten in Produkte umgewandelt werden, während die Geschwindigkeitskonstante ein Verhältnismäßigkeitskoeffizient ist, der die Geschwindigkeit einer chemischen Reaktion bei einer bestimmten Temperatur auf die Konzentration des Reaktanten oder auf das Produkt der Reaktantenkonzentrationen bezieht.
Wenn ein oder mehrere Reaktanten in Produkte umgewandelt werden, können sie unterschiedliche Modifikationen und Energieveränderungen durchlaufen. Die chemischen Bindungen in den Reaktanten werden gebrochen, und es werden neue Bindungen gebildet, um Produkte zu erzeugen, die sich völlig von den Reaktanten unterscheiden. Diese chemische Modifikation wird als chemische Reaktionen bezeichnet. Reaktionsgeschwindigkeit und Geschwindigkeitskonstante sind wichtige chemische Konzepte, die mehr Informationen zu chemischen Reaktionen liefern können.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist Reaktionsgeschwindigkeit
3. Was ist die Geschwindigkeitskonstante
4. Seite für Seitenvergleich - Reaktionsgeschwindigkeit gegenüber der Geschwindigkeit konstant in tabellarischer Form
5. Zusammenfassung
Was ist Reaktionsgeschwindigkeit?
Die Reaktionsgeschwindigkeit oder Reaktionsrate ist die Geschwindigkeit, mit der Reaktanten in Produkte umgewandelt werden. Die Reaktionsgeschwindigkeit ist einfach die Indikation der Reaktionsgeschwindigkeit. Daher können wir es als einen Parameter betrachten, der bestimmt, wie schnell oder wie langsam die Reaktion ist. Natürlich sind einige Reaktionen sehr langsam, sodass wir die Reaktion nicht einmal erkennen können, wenn wir sie nicht sehr lange beobachten. Zum Beispiel ist die Verstärkung durch chemische Prozesse eine langsame Reaktion, die im Laufe der Jahre stattfindet. Im Gegensatz dazu ist die Reaktion eines Kaliumstücks mit Wasser sehr schnell und erzeugt eine große Menge Wärme; Somit wird es als kräftige Reaktion angesehen.
Betrachten Sie die folgende Reaktion, bei der die Reaktanten A und B in Produkte C und D verwandelt werden.
a a + b b ⟶ c c + d d
Wir können die Rate für die Reaktion anhand der beiden Reaktanten oder Produkte angeben.
Rate = -(1/a) (da/dt) = -(1/b) (db/dt) = (1/c) (dc/dt) = (1/d) (dd/dt)
Hier sind A, B, C und D stöchiometrische Koeffizienten der Reaktanten und Produkte. Für die Reaktanten sollten wir die Geschwindigkeitsgleichung mit einem Minuszeichen schreiben, da die Produkte im Laufe der Reaktion abnehmen. Mit zunehmender Produkte müssen wir jedoch positive Anzeichen verwenden.

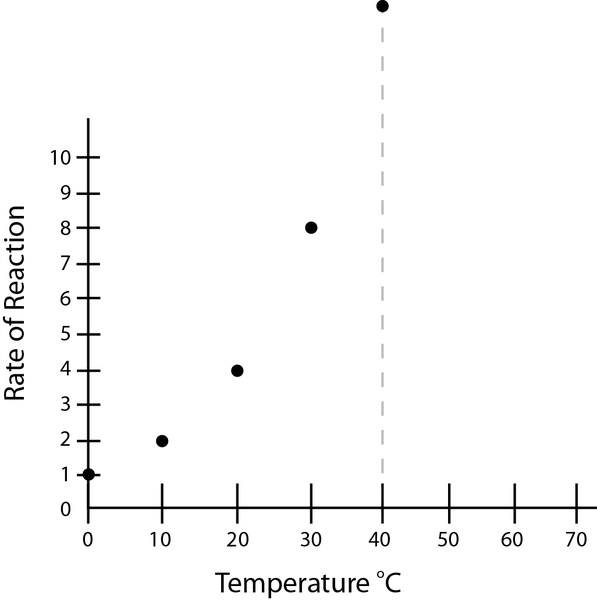
Abbildung 01: Erhöhung einer bestimmten Reaktionsrate mit zunehmender Temperatur
Chemische Kinetik ist die Untersuchung der Reaktionsgeschwindigkeiten, und es gibt viele Faktoren, die die Geschwindigkeit der Reaktion beeinflussen. Diese Faktoren umfassen Konzentrationen der Reaktanten, Katalysatoren, Temperatur, Lösungsmitteleffekte, pH -Wert, Produktkonzentrationen usw. Wir können diese Faktoren optimieren, um die maximale Reaktionsrate zu haben, oder wir können diese Faktoren anpassen, um die erforderlichen Reaktionsgeschwindigkeiten zu manipulieren.
Was ist die Geschwindigkeitskonstante?
Die Geschwindigkeitskonstante ist ein Verhältnismäßigkeitskoeffizient, der die Geschwindigkeit einer chemischen Reaktion bei einer bestimmten Temperatur auf die Konzentration des Reaktanten oder auf das Produkt der Reaktantenkonzentrationen bezieht. Wenn wir die Geschwindigkeitsgleichung in Bezug auf den Reaktanten A für die oben angegebene Reaktion schreiben, ist sie wie folgt.
R = -k [a]A [B]B
In dieser Reaktion ist k die Geschwindigkeitskonstante. Es ist eine Verhältnismäßigkeitskonstante, die von der Temperatur abhängt. Wir können die Geschwindigkeit und die Geschwindigkeitskonstante einer Reaktion durch Experimente bestimmen.
Was ist der Unterschied zwischen Reaktionsgeschwindigkeit und Geschwindigkeitskonstante?
Der Schlüsselunterschied zwischen Reaktionsgeschwindigkeit und Geschwindigkeitskonstante besteht darin, dass die Reaktionsgeschwindigkeit oder die Reaktionsgeschwindigkeit die Geschwindigkeit ist, mit der Reaktanten in Produkte umgewandelt werden der Reaktant oder das Produkt der Konzentrationen von Reaktanten. Sowohl die Reaktionsgeschwindigkeit als auch die Geschwindigkeitskonstante geben einen Hinweis auf die Reaktionsgeschwindigkeit. Die Geschwindigkeitskonstante allein kann jedoch keine gültige Aussage über die Reaktionsgeschwindigkeit geben.
Zusammenfassung -Reaktionsgeschwindigkeit gegen Geschwindigkeitskonstante
Der Schlüsselunterschied zwischen Reaktionsgeschwindigkeit und Geschwindigkeitskonstante besteht darin, dass die Reaktionsgeschwindigkeit oder die Reaktionsgeschwindigkeit die Geschwindigkeit ist, mit der Reaktanten in Produkte umgewandelt werden der Reaktant oder das Produkt der Konzentrationen von Reaktanten.
Referenz:
1. Helmenstine, Anne Marie. „Was ist die Geschwindigkeitskonstante in der Chemie??”Thoughtco, Sep. 27, 2018, hier erhältlich.
Bild mit freundlicher Genehmigung:
1. "Reaktionsgeschwindigkeitserhöhung mit zunehmender Temperatur" vom Brazosport College - eigene Arbeit (CC BY -SA 3.0) über Commons Wikimedia


