Unterschied zwischen abgelaufenem Limetten und Limettenwasser
Der Schlüsselunterschied Zwischen geschaltetem Limetten- und Limettenwasser ist das Die Produktion von abgelaufenem Kalk erfolgt durch Zugabe von Wasser zu Calciumoxid, während die Produktion des Kalkwassers durch Rühren von Calciumhydroxid in reinem Wasser erfolgt.
Sowohl geschaltete Limetten- als auch Limettenwasser enthält Calciumhydroxid als wässrige Lösung. Diese beiden Lösungen unterscheiden sich jedoch hauptsächlich nach ihrem Vorbereitungsverfahren und dem Rohstoff, den wir in ihrer Produktion verwenden. Der gebräuchliche Name von Kalkwasser ist „Milch der Limette“ aufgrund der Farbe der Lösung.
INHALT
1. Überblick und wichtiger Unterschied
2. Was ist abgelaufener Kalk
3. Was ist Kalkwasser
4. Nebenseitiger Vergleich - Limette Limette gegen Kalkwasser in tabellarischer Form
5. Zusammenfassung
Was ist abgelaufener Kalk?
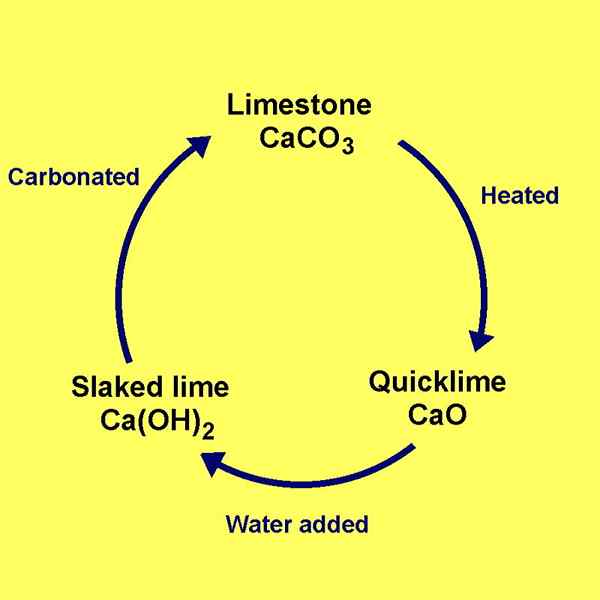
Limette Kalk ist hydratisiert Calciumhydroxid. Wir können diese Lösung produzieren, indem wir Wasser zu Calciumoxid hinzufügen. Der gebräuchliche Name von Calciumoxid ist "QuickLime". Wir können Quicklime erhalten, indem wir Kalkstein bei einer Temperatur bei oder über 900 Celsius erhitzen. Die Zugabe von Wasser zu diesem Calciumoxid ist eine gefährliche Reaktion, da es sehr exotherm ist.

Abbildung 01: Vorbereitung von Limettenlimetten
Limette limitiert ist entweder als Pulver oder Granulat erhältlich. Das Endprodukt der Reaktion, aus dem wir diese Verbindung produzieren. Diese Verbindung ist als Neutralisierungsmittel für industrielles Abwasser und auch für die Rauchgasreinigung wichtig. Darüber hinaus kann sich diese Verbindung mit Kohlendioxid in der Luft mischen, um Kalkstein durch Freisetzung von Wasser zu bilden.
Was ist Kalkwasser?
Kalkwasser ist eine gesättigte Lösung von Calciumhydroxid. Wir sollten diesen Begriff nicht mit dem „Limetten“ der Frucht vergleichen, da er völlig nichts mit Limettenwasser zu tun hat, das wir hier sprechen. Reines Kalkwasser ist farblos. Es hat einen leichten erdigen Geruch mit einem bitteren alkalischen Geschmack. Wir können diese Lösung durch rührendes Calciumhydroxid mit reinem Wasser produzieren und dann sollten wir das überschüssige Calciumhydroxid filtern, das ungelöst bleibt. Daher können wir eine gesättigte Lösung von Calciumhydroxid erhalten. Der gebräuchliche Name dieser Lösung ist „Milch von Kalk“. Der normale pH dieser Lösung beträgt 12.4. Dies bedeutet, dass es eine grundlegende Natur hat. Es gibt viele wichtige gesundheitliche Vorteile dieser Lösung
- Es kann unseren Wasserverbrauch fördern
- Hilft bei der Verdauung
- Außerdem kann es die Wahrscheinlichkeit eines Krebses verringern
- Verbessert die Hautqualität
- Es fördert Gewichtsverlust
Was ist der Unterschied zwischen geschaltetem Limetten- und Limettenwasser?
Slaked Lime ist hydratisiert Calciumhydroxid, während Kalkwasser eine gesättigte Lösung von Calciumhydroxid ist. Darüber hinaus verfügt ein Limettenlima in seiner ungesättigten Form Calciumhydroxid, während Kalkwasser in seiner gesättigten Form in der chemischen Natur dieser Lösungen Calciumhydroxid aufweist. In ähnlicher Weise produzieren wir abgelöstes Kalk aus Calciumoxid, während wir Kalkwasser aus Calciumhydroxid produzieren. Nachfolgend inforengraphisch enthält weitere Details zum Unterschied zwischen abgelaufenem Limetten- und Limettenwasser in tabellarischer Form.

Zusammenfassung -Limette gegen Limettenwasser geschlagen
Sowohl geschlagene Limetten- als auch Limettenwasser haben Calciumhydroxid. Der wichtigste Unterschied zwischen geschaltetem Kalk und Limettenwasser besteht darin, dass wir abgelöschtes Kalk produzieren, indem wir Calciumoxid Wasser hinzufügen, während das Kalkwasser durch Rühre Calciumhydroxid in reinem Wasser erzeugt wird.
Referenz:
1. “Limette geschlagen.Nordkalk. Hier verfügbar
2. Fletcher, Jenna. „12 gesundheitliche Vorteile von Kalkwasser.”Medical News Today, Medilexicon International. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."The Lime Cycle" von Peter Bell - eigener Arbeit (CC BY -SA 3).0) über Commons Wikimedia


