Unterschied zwischen Farben, die durch Alkali -Metalle und Calcium erzeugt werden

Der Schlüsselunterschied Zwischen Farben, die durch Alkali -Metalle und Kalzium erzeugt werden, ist das, dass die Calcium erzeugt eine charakteristische orange-rote Flammenfarbe, die eine der Alkalikalkalle nicht erzeugen kann.
Der Flame -Test ist eine qualitative Analysetechnik, bei der wir eine Idee erhalten, um ein bestimmtes chemisches Element zu identifizieren, indem wir uns die Flammenfarbe ansehen, die es gibt, wenn wir dieses Element verbrennen. hauptsächlich Metalle. Wir können diese analytische Technik jedoch nicht verwenden, um alle Metalle zu identifizieren, die wir kennen, da einige Metalle keine Flammenfarbe ergeben und einige Metalle Flammenfarben gemeinsam haben.
INHALT
1. Überblick und wichtiger Unterschied
2. Was sind Farben, die von Alkali -Metallen erzeugt werden?
3. Was sind Farben, die von Kalzium erzeugt werden?
4. Seite für Seitenvergleich - Farben, die von Alkali -Metallen und Calcium in tabellarischer Form erzeugt werden
6. Zusammenfassung
Was sind die Farben, die von Alkali -Metallen erzeugt werden??
Farben, die von Alkali -Metallen erzeugt werden, variieren je nach Metall. Alkali -Metalle sind die chemischen Elemente der Gruppe 1. Die Mitglieder dieser Gruppe sind Lithium, Natrium, Kalium, Rubidium und Cäsium. Für diese Metalle der Gruppe 1 ist der Flammentest die einfachste Art, das Metall zu identifizieren, da sie Farben angeben, die sich voneinander unterscheiden. Betrachten wir nun die Methode zur Durchführung eines Flammentests.
- Reinigen Sie einen Platindraht, indem Sie ihn in konzentrierte HCL -Säure eintauchen.
- Dann halten Sie es in einer heißen Bunsen -Flamme.
- Wir sollten die obigen zwei Schritte wiederholen, bis der Platindraht keine Flammenfarbe zeigt.
- Dann befeuchten Sie den Draht erneut in Säure und tauchen Sie ihn in die Probe des Metalls ein, das wir testen werden.
- Halten Sie den Draht als nächstes zusammen mit der Probe in einem heißen Bunsenbrenner. Dies zeigt eine andere Farbe, die die Flammenfarbe des Probenmetalls ist

Abbildung 01: Die Flammenfarbe von Rubidium
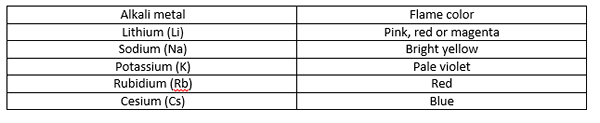
Wenn wir das Probenmetall in der Flamme halten, führt die Wärmeenergie der Flamme dazu. Wir nennen diese „Anregung von Elektronen“. Diese Erregung ist jedoch sehr instabil. So kommt das Elektron sofort zu dem Ort zurück, an dem es war, und löst Energie als sichtbares Licht frei. Wir erkennen dies als Flammenfarbe. Darüber hinaus hat die Farbe größerer Atome oft eine geringe Intensität als die von kleinen Atomen. Die von Alkali -Metallen erzeugten Flammenfarben sind wie folgt:
Was sind die Farben, die von Kalzium erzeugt werden??
Der Flammentest für Kalzium liefert eine charakteristische orange-rote Farbe, die jedes andere Metall nicht produzieren kann.

Abbildung 02: Flammenfarbe von Kalzium
Obwohl Rubidium in der Alkali -Metallgruppe auch eine rote Farbe erzeugt, unterscheidet es sich von der Farbe von Calcium hauptsächlich aufgrund der Differenz der Größen der beiden Atome (Rubidium hat eine zusätzliche Elektronenschale als das Calciumatom; daher unterscheiden sich die Elektronenanregungen von einer zusätzlichen Elektronenschale als das Calciumatom. gegenseitig. Dies führt zu verschiedenen Flammenfarben).
Was ist der Unterschied zwischen Farben, die von Alkali -Metallen und Kalzium erzeugt werden?
Alkali -Metalle erzeugen verschiedene Flammenfarben, die es einfach machen, ein Alkali -Metall von einem anderen zu identifizieren. Zum Beispiel Lithium - Magenta -Farbe, Natrium - hellgelb, Kalium - blasse Violett, Rubidium - Rot und Cäsium - Blau. Die durch Kalzium erzeugte Flammenfarbe unterscheidet sich jedoch von all diesen Farben. Es erzeugt eine orange-rote Farbe, die nur eine charakteristische Flammenfarbe von Kalzium ist (kein anderes Metall ergibt die gleiche Farbe). Dies ist der Unterschied zwischen Farben, die durch Alkali -Metalle und Calcium erzeugt werden.

Zusammenfassung -Farben, die von Alkali -Metallen und Calcium erzeugt werden
Unterschiedliche Metalle erzeugen eine unterschiedliche Flammenfarbe, wenn wir sie verbrennen. Die durch Kalzium erzeugte Farbe ist für Kalzium charakteristisch; Somit können wir es von den Flammenfarben unterscheiden, die von Alkali -Metallen angegeben sind. Der Unterschied zwischen Farben, die durch Alkali-Metalle und Kalzium erzeugt werden, besteht darin, dass Calcium eine charakteristische orange-rote Flammenfarbe erzeugt.
Referenz:
1. Helmenstine, Anne Marie. „Wie Flammentestfarben erzeugt werden.Denkey, Thandouledco. Hier verfügbar
2. Libretexten. „Flammentests.”Chemie libretexten, libretexten, 17. Februar. 2018. Hier verfügbar
Bild mit freundlicher Genehmigung:
1."Die Flammenfärung des Rubidiums" von Didaktische.Medien - eigene Arbeit, (CC BY -SA 3.0) über Commons Wikimedia
2.”356886434" von TJMWATSON (CC von 2.0) über Flickr


